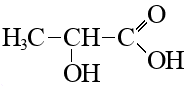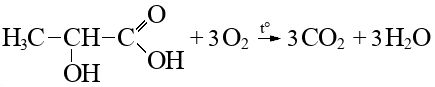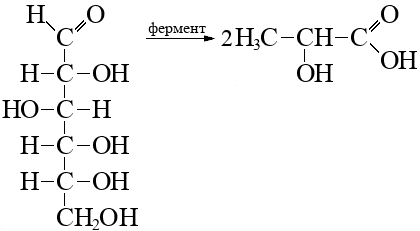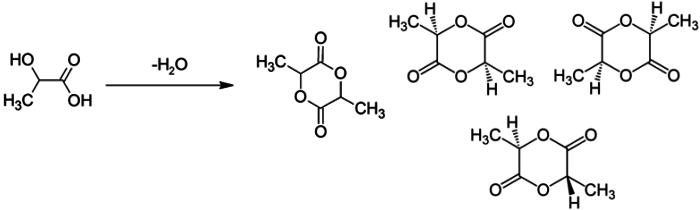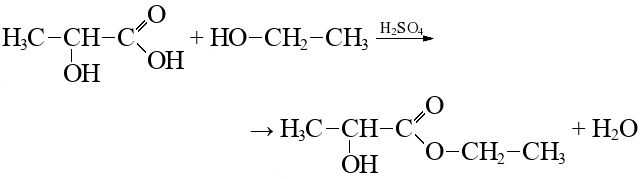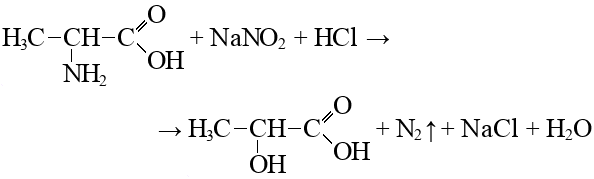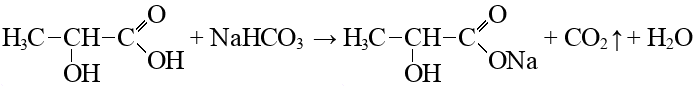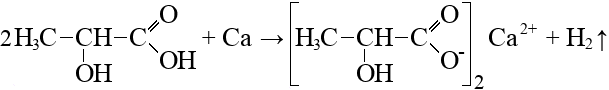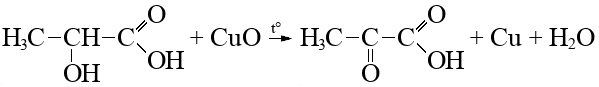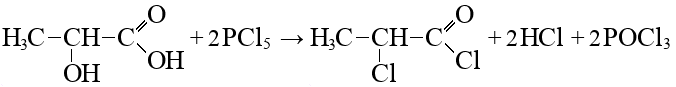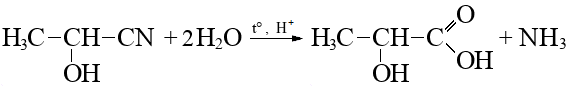Предметный тур. Химия. 3 этап
«Мир химических процессов подобен театральным подмосткам, на которых разыгрывается сцена за сцена. Действующие лица в них — элементы. Каждому из элементов назначена своя особенная роль: иногда роль статиста, иногда роль одного из главных действующих лиц».
К. Винклер, немецкий химик, 1897 г.

Неизвестный химический элемент A относится к группе биотических элементов. Его соединения в высшей степени окисления обладают выраженными окислительными свойствами, тогда как катионная форма A — необходимый кофактор ферментативной активности в организме. Он является изотопно-чистым элементом, так как состоит из единственного стабильного изотопа. Искусственно полученные изотопы используют преимущественно в научных целях.
Установите неизвестный элемент и осуществите неорганические синтезы с участием исходной соли нитрата A согласно схеме:
- Соль элемента A образует аддукт \(\ce{A(NO3)2*9NH3}\). Массовая доля \(\omega_A = 16{,}566\%\).
- Обработка водного раствора соли нитрата нашатырным спиртом и углекислым газом приводит к осаждению светло-розового твердого вещества — компонента микроудобрений и смесей премиксов. Побочный продукт реакции, нитрат аммония, используется в качестве удобрения (реакция 1).
- Твердый продукт реакции 1 выделили, высушили и разделили на три порции. В первую порцию добавили разбавленную азотную кислоту (реакция 2); вторую поместили в воду и пропустили углекислый газ (реакция 3). В обоих случаях осадок растворился. Третью порцию влажного осадка обработали сернистым ангидридом (реакция 4).
- Соль нитрат прокалили; при этом получился осадок бурого цвета. Известно, что в древности данный минерал использовали как компонент пигментных красок (реакция 5). Это же самое вещество можно получить при взаимодействии катионной и анионной форм элемента A (реакция 6).
- Анионная форма элемента A является растворимой солью сильной неорганической кислоты фиолетово-красного цвета, которая в чистом виде не выделена. Данная кислота может быть получена по реакции ионного обмена с раствором серной кислоты (реакция 7). Альтернативный синтез кислоты проводят с использованием исходной соли нитрата в среде азотной кислоты в присутствии нитрата свинца (II) (реакция 8). При взаимодействии водного раствора данной соли с газообразным веществом с запахом тухлой рыбы происходит обесцвечивание раствора (реакция 9).
- Из анионной соли элемента A в присутствии серной концентрированной кислоты можно получить высший оксид \(\ce{A_xO_y}\) — маслянистая жидкость с металлическим блеском, изменяющая окраску в проходящем свете с зеленой на красную (реакция 10). Данное вещество разлагается со взрывом, при этом выделяются аллотропные модификации одного из биогенных элементов (реакции 11–12).
- Высший оксид элемента A, в отличие от низшего, легко растворяется в щелочах и воде (реакции 13–14).
| Уравнения и расчеты | Критерии оценивания | |
|---|---|---|
| 1. | Соль элемента А образует аддукт \(\ce{A(NO3)2*9NH3}\). Массовая доля \(\omega_A = 16{,}566\%\), поэтому: \[M_A = \frac{x}{x + 62\cdot 2 + 9\cdot 17} = 0{,}16566;\] \[M_A = 54{,}9 \approx 55 \text{ г/моль}.\] Это марганец Mn. | 1 балл |
| 2. | Реакция 1: \[\ce{Mn(NO3)2 + 2H2O + CO2 + 2NH3 -> 2NH4NO3 + MnCO3 v}.\] | 1 балл |
| 3. | Реакция 2: \[\ce{MnCO3 + 2HNO3 -> Mn(NO3)2 + CO2 ^ + H2O}.\] | 1 балл |
| 4. | Реакция 3: \[\ce{MnCO3 + CO2 + H2O -> Mn(HCO3)2}.\] | 1 балл |
| 5. | Реакция 4: \[\ce{MnCO3 + SO2 + 3H2O -> CO2 ^ + MnSO3*3H2O}.\] | 3 балла |
| 6. | Реакция 5: \[\ce{Mn(NO3)2 ->[180°C] MnO2 v + 2NO2 ^}.\] | 2 балла |
| 7. | Реакция 6: \[\ce{3Mn(NO3)2 + 2KMnO4 + 2H2O -> 5MnO2 v + 2KNO3 + 4HNO3}.\] | 3 балла |
| 8. | Реакция 7: \[\ce{Ba(MnO4)2 + H2SO4 -> 2HMnO4 + BaSO4 v}.\] | 1 балл |
| 9. | Реакция 8: \[\ce{2Mn(NO3)2 + 5PbO2 + 6HNO3 -> 2HMnO4 + 5Pb(NO3)2 + 2H2O}.\] | 3 балла |
| 10. | Реакция 9: \[\ce{3PH3 + 8KMnO4 -> 2K3PO4 + K2HPO4 + 8MnO2 v + 4H2O}.\] | 3 балла |
| 11. | Реакция 10: \[\ce{2KMnO4 + H2SO4 -> Mn2O7 + K2SO4 + H2O}\] или можно с \(\ce{KHSO4}\). | 1 балл |
| 12. | Реакция 11: \[\ce{2Mn2O7 ->[t] 4MnO2 v + 3O2 ^}.\] | 1 балл |
| 13. | Реакция 12: \[\ce{Mn2O7 ->[t] 2MnO2 v + O3 ^}.\] | 2 балла |
| 14. | Реакция 13: \[\ce{Mn2O7 + H2O -> 2HMnO4}.\] | 1 балл |
| 15. | Реакция 14: \[\ce{Mn2O7 + 2KOH -> 2KMnO4 + H2O}.\] | 1 балл |
| Итого | 25 баллов | |
Для регулирования всех пищевых добавок и информирования потребителей каждой добавке присваивается уникальный номер, называемый «номер E». Система нумерации была доработана и принята для международной классификации Кодекс Алиментариус. Первая цифра кода говорит об общем назначении добавки. Например, E200 – E299 Консерванты.
Межгосударственный стандарт ГОСТ 33294-2015 регламентирует требования к качеству пищевой добавки Е249 Нитрит калия на территории Российской Федерации. Ее используют в пищевой промышленности как защиту от ботулотоксина. Нитритную соль добавляют в сырокопченые, вареные, полукопченые колбасы, сосиски, сардельки и ветчину.

Пищевая добавка E252 Нитрат калия относится к консервантам синтетического происхождения, используется в технологических целях в процессе производства пищевых продуктов для увеличения длительности хранения.
При проведении оценки качества поступившей в лабораторию партии нитрата калия было обнаружено, что нарушена герметичность первичной упаковки. Для предварительной экспертизы качества пищевой добавки навеску образца нитрата калия массой 28,7 г, содержащего в качестве примеси нитрит калия, нагревали до постоянного веса (реакция 1).
Остаток, представляющий собой единственное сложное вещество, смешали с порцией нашатыря; данную порошковую смесь растворили в горячей воде (реакция 2). Объем газа, выделившегося по первой реакции, в три раза меньше объема газа по второй реакции.
Установите массовые доли компонентов исходного образца, предоставленного для экспертизы. Рассчитайте массовую долю нейтронов в этой навеске.
К охлажденному раствору (реакция 2) массой 100 г добавили 15%-й раствор хлората натрия до полного протекания реакции. Вычислите массовую долю растворенного вещества.
| Уравнения и расчеты | Критерии оценивания | |
|---|---|---|
| 1. | Пусть в навеске образца было \(x\) моль \(\ce{KNO2}\) и \(y\) моль \(\ce{KNO3}\), тогда: \[m_{\text{смеси}} = 85x + 101y = 28{,}7.\] | 2 балла |
| 2. | Реакция I: \[{\overset{y \textrm{\,моль}}{\underset{85\textrm{\,г/моль}}{\ce{2KNO3}}}} \ce{ ->[t]} \overset{x \textrm{\,моль}}{\ce{2KNO2}}+ \overset{0{,}5y \textrm{\,моль}}{\ce{O2 }}.\] При температуре протекает разложение \(\ce{KNO3}\), и образуется дополнительная порция нитрита калия. Это единственное сложное вещество по реакции 1. | 3 балла |
| 3. | Реакция II: \[\ce{KNO2 + NH4Cl ->[t] KCl + N2 + 2H2O}.\] | 1 балл |
| 4. | После прокаливания: \[n_{\text{общ I+II}} \ce{KNO2} = (x + y) \text{ моль};\] \[\frac{n{\ce{O2}}}{n{\ce{N2}}} = \frac{1}{3} = \frac{0{,}5y}{x + y};\] \[x = 0{,}5y.\] | 2 балла |
| 5. | Решаем систему уравнений: \[\begin{cases} 85x + 101y = 28{,}7, \\ 0{,}5y = x. \end{cases}\] \(y = 0{,}2\) моль — исходное количество \(\ce{KNO3}\); \(x = 0{,}1\) моль — исходное количество \(\ce{KNO2}\) (примесь). | 3 балла |
| 6. | \[m_{\text{исх}} \ce{KNO2} = 0{,}1 \cdot 85 = 8{,}5 \text{ г};\] \[m_{\text{исх}} \ce{KNO3} = 0{,}2 \cdot 101 = 20{,}2 \text{ г};\] \[\omega_{\ce{KNO2}} = \frac{8{,}5}{28{,}7} \cdot 100\% = 29{,}62\%;\] \[\omega_{\ce{KNO3}} = \frac{20{,}2}{28{,}7} \cdot 100\% = 70{,}38\%.\] | 3 балла |
| 7. | \[n_{\text{нейтронов KNO2}} = 20 + 7 + 2 \cdot 8 = 43;\] \[n_{\text{нейтронов KNO3}} = 20 + 7 + 3 \cdot 8 = 51;\] \[m_{\text{нейтронов общ}} = 43 \cdot 0{,}1 + 51 \cdot 0{,}2 = 14{,}5 \text{ г};\] \[\omega_{\text{нейтронов}} = \frac{14{,}5}{28{,}7} \cdot 100\% = 50{,}52\%.\] | 2 балла |
| 8. | \[\overset{0.3 \textrm{\,моль}}{\ce{KCl}} + \overset{0.3 \textrm{\,моль}}{\ce{NaClO3}} \ce{ ->[\text{охлаждение}]} \overset{0.3 \textrm{\,моль}}{\ce{KClO3 v}} + \overset{0.3 \textrm{\,моль}}{\ce{NaCl}}.\] | 3 балла |
| 9. | \[m_{\text{NaClO3}} = 0{,}3 \cdot 106{,}5 = 31{,}95 \text{ г};\] \[m_{\text{KClO3}} = 0{,}3 \cdot 122{,}5 = 36{,}75 \text{ г}.\] Растворимость хлората калия низкая, поэтому при комнатной температуре из раствора выпадает осадок. | 2 балла |
| 10. | \[m_{\text{исх р-р NaClO3}} = \frac{31{,}95}{0{,}15} = 213 \text{ г}.\] | 1 балл |
| 11. | \[\begin{gather} m_{\text{конеч. р-р}} = m_{\text{исх. р-р} \ce{NaClO3}} + m_{\text{исх. р-р}\ce{KCl}} - m_{\ce{KClO3}} =\\= 213 + 100 - 36,75 = 276,25 \text{ г}. \end{gather}\] | 2 балла |
| 12. | \[m_{\text{NaCl}} = 0{,}3 \cdot 58{,}5 = 17{,}55 \text{ г};\] \[\omega_{\text{NaCl}} = \frac{17{,}55}{276{,}25} \cdot 100\% = 6{,}35\%.\] | 1 балл |
| Итого | 25 баллов | |

Преимущественное использование бериллия и его соединений: металлургия, ядерная энергетика, аэрокосмическая техника. Из-за высокой токсичности его соединения не используются для пищевой промышленности. Бериллиевая бронза — это цветной сплав, используемый в пружинах, датчиках нагрузки и других деталях, которые должны сохранять свою форму при многократных нагрузках и деформациях. Применяется для изготовления инструмента, не издающего искрения при использовании — такой инструмент незаменим при работе в пожаро- и взрывоопасных условиях. Изделия, изготовленные из бериллиевой бронзы, имеют пометку «BeCu».
Образец экспериментального сплава, содержащего бериллий, медь, кремний, растворили в горячем растворе гидроксида калия. При этом выделилось 7,258 л газа и образовался твердый остаток массой 54,4 г.
Идентичную навеску смеси металлов растворили в разбавленной азотной кислоте. При этом выделилось 15,456 л газа.
Определите массовые доли веществ в смеси (в процентах). Рассчитайте минимальный объем 10%-го раствора гидроксида калия (\(\rho=1{,}1187\) г/мл при н. у.), необходимого для полного растворения навески.
| Уравнения и расчеты | Критерии оценивания | |
|---|---|---|
| 1. | Реакция I: \[\ce{Be + 2KOH + 2H2O -> K2[Be(OH)4] + H2 }.\] | 3 балла |
| 2. | Реакция II: \[\ce{Si + 2KOH + H2O -> K2SiO3 + 2H2 ^}.\] | 2 балла |
| 3. | Cu со щелочью не реагирует, поэтому масса твердого остатка: \[n{\ce{Cu}} = \frac{54{,}4\ \text{г}}{64\ \text{г/моль}} = 0{,}85\ \text{моль}.\] И в первой, и во второй порции. | 1 балл |
| 4. | \[n \ce{H2}\text{общ}_{I+II} = \frac{7{,}258\ \text{л}}{22{,}4\ \text{л/моль}} = 0{,}324\ \text{моль}.\] | 1 балл |
| 5. | Si с азотной кислотой не реагирует. | 1 балл |
| 6. | \[n \ce{NO} \text{общ}_{III+IV} = \frac{15{,}456\ \text{л}}{22{,}4\ \text{л/моль}} = 0{,}69\ \text{моль}.\] | 1 балл |
| 7. | Реакция III: \[\ce{3Cu + 8HNO3_{\text{разб}} -> 3Cu(NO3)2 + 2NO + 4H2O ^};\] \[\frac{n{\ce{Cu}}}{n{\ce{NO}}} = \frac{3}{2} = \frac{0{,}85\ \text{моль}}{0{,}567\ \text{моль}}.\] | 3 балла |
| 8. | Реакция IV: \[\ce{3Be + 8HNO3_{\text{разб}} -> 3Be(NO3)2 + 2NO + 4H2O ^}.\] | 3 балла |
| 9. | \[n\ce{NO}_{IV} = (0{,}69 - 0{,}567)\ \text{моль} = 0{,}123\ \text{моль};\] \[\frac{n{\ce{Be}}}{n{\ce{NO}}} = \frac{3}{2} = \frac{0{,}185\ \text{моль}}{0{,}123\ \text{моль}}.\] И в первой, и во второй порции. | 2 балла |
| 10. | \[n\ce{H2}\text{общ}_{II} = 0{,}324 - 0{,}185 = 0{,}139\ \text{моль};\] \[n\ce{H2}\text{общ}_{II} = 2n{\ce{Si}} = 0{,}139\ \text{моль}.\] | 1 балл |
| 11. | \[m{\ce{Cu}} = 0{,}85 \cdot 64 = 54{,}4\ \text{г};\] \[m{\ce{Be}} = 0{,}185 \cdot 9 = 1{,}665\ \text{г};\] \[m{\ce{Si}} = 0{,}0695 \cdot 28 = 1{,}946\ \text{г}.\] | 2 балла |
| 12. | \[m_{\text{смеси}} = 58{,}011\ \text{г} \approx 58\ \text{г}.\] | 1 балл |
| 13. | \[\omega{\ce{Cu}} = 93{,}79\%;\] \[\omega{\ce{Be}} = 2{,}87\%;\] \[\omega{\ce{Si}} = 3{,}36\%.\] | 1 балл |
| 14. | По реакции I+II: \[n\ce{KOH}_{\text{общ}} = 0{,}37 + 0{,}139 = 0{,}509\ \text{моль};\] \[m\ce{KOH} = 0{,}509 \cdot 56 = 28{,}504\ \text{г} \approx 28{,}5\ \text{г}.\] | 1 балл |
| 15. | \[m{KOH_\text{р-ра}} = 285\ \text{г}.\] | 1 балл |
| 16. | \[V_{\text{р-ра}} = \frac{m_{\text{р-ра}}}{\rho} = 254{,}76\ \text{мл}.\] | 1 балл |
| Итого | 25 баллов | |
Антисептическое действие перекиси водорода обусловлено оксидантным эффектом и создает неблагоприятные условия для развития микроорганизмов, особенно анаэробной и гнилостной флоры; вместе с тем оно характеризуется малой продолжительностью и слабой выраженностью эффекта. Ее растворы применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией и упаковки молочной продукции и соков.
Порцию неизвестного щелочного металла массой 23,455 г окислили кислородом при низких температурах (вещество А). Полученный остаток массой 31,4 г растворили в горячей воде. При этом выделилось 2,24 л газа (н. у.). Образовавшийся раствор нейтрализовали 219 г раствора 10%-й соляной кислоты. Какой металл подвергнут окислению? Запишите уравнения реакций, упомянутых в задаче. Вычислите массовые доли продуктов окисления металла.
Вещество А, обладающее окислительно-восстановительными свойствами, выделили и ввели в следующие неорганические синтезы:
- Перекись водорода — прозрачная бесцветная жидкость без запаха или со слабым своеобразным запахом, слабокислой реакции. Ее можно получить на холоде по реакции 1.
- Раствор, полученный по реакции 1, частично выпарили и добавили навеску иодида калия в недостатке. В данной системе наблюдалось последовательное выпадение и растворение осадка с образованием бесцветного раствора (реакция 2–3).
- Одно из веществ, полученных в реакции 1, прореагировало с гипохлоритом кальция. Наблюдалось выделение газа без запаха (реакция 4).
- Вещество А (из расчетной задачи) может реагировать с сернистым ангидридом с образованием соли Б (реакция 5). Такая же соль образуется, если вещество А реагирует с подкисленным раствором сульфата железа (II) (реакция 6).
- При реагировании вещества А с серой образуется два сложных вещества (реакция 7).
| Уравнения и расчеты | Критерии оценивания | |
|---|---|---|
| 1. | По уравнению реакции нейтрализации определим металл: \[\ce{MeOH + HCl -> MeCl + H2O};\] \[m_{\ce{HCl}} = 219 \cdot 0{,}1 = 21{,}9\ \text{г};\] \[n{\ce{HCl}} = \frac{21{,}9}{36{,}5} = 0{,}6\ \text{моль};\] \[n{\ce{HCl}} = n{\ce{MeOH}} = 0{,}6\ \text{моль};\] \[M_{\ce{Me}} = \frac{23{,}455}{0{,}6} = 39{,}09\ \text{г/моль}.\] Это калий K. | 5 баллов |
| 2. | \[\ce{KOH + HCl -> KCl + H2O}.\] | 1 балл |
| 3. | \[\ce{2K + O2 ->[\text{низкие\ температуры}] K2O2}.\] Вещество A — пероксид калия. | 2 балла |
| 4. | \[\ce{K2O2 + 2K -> 2K2O}.\] | 1 балл |
| 5. | \[\ce{2K2O2 + 2H2O -> 4KOH + O2 }.\] | 2 балла |
| 6. | \[\ce{K2O + H2O -> 2KOH}.\] | 1 балл |
| 7. | Газ — это , \(n{\ce{O2}} = 0{,}1\) моль. \[\overset{0{,}2 \textrm{\,моль}}{\ce{2K2O2}} + \overset{0{,}2 \textrm{\,моль}}{\ce{2H2O}}\ce{ ->[t]} \overset{0{,}4 \textrm{\,моль}}{\ce{4KOH}} + \overset{0{,}1 \textrm{\,моль}}{\ce{O2}} ;\] \[m{\ce{K2O2}} = 110 \cdot 0{,}2 = 22{,}0\ \text{г}.\] | 2 балла |
| 8. | \[m{\ce{K2O}} = 31{,}4 - 22{,}0 = 9{,}4\ \text{г};\] \[n{\ce{K2O}} = \frac{9{,}4}{94} = 0{,}1\ \text{моль}.\] | 1 балл |
| 9. | \[\omega{\ce{K2O}} = \frac{9{,}4}{31{,}4} \cdot 100\% = 29{,}94\%;\] \[\omega{\ce{K2O2}} = \frac{22{,}0}{31{,}4} \cdot 100\% = 70{,}06\%.\] | 1 балл |
| 10. | Реакция 1: \[\ce{K2O2 + 2H2O ->[\text{холод}] 2KOH + H2O2}.\] | 1 балл |
| 11. | Реакция 2: \[\ce{H2O2 + 2KI -> I2 + 2KOH}.\] | 1 балл |
| 12. | Реакция 3: \[\ce{3H2O2 + KI ->[\text{щелочная\ среда}] KIO3 + 3H2O}.\] | 2 балла |
| 13. | Реакция 4: \[\ce{2H2O2 + Ca(ClO)2 -> CaCl2 + 2O2 ^ + 2H2O}.\] | 1 балл |
| 14. | Реакция 5: \[\ce{K2O2 + SO2 -> K2SO4}.\] | 1 балл |
| 15. | Реакция 6: \[\ce{K2O2 + 2H2SO4 + 2FeSO4 -> Fe2(SO4)3 + K2SO4 + 2H2O}.\] | 1 балл |
| 16. | Реакция 7: \[\ce{3K2O2 + S -> K2SO4 + 2K2O}.\] | 2 балла |
| Итого | 25 баллов | |
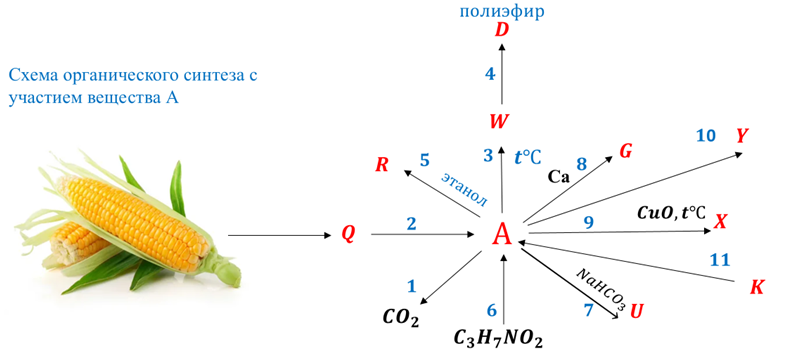
Навеску вещества А природного происхождения массой 31,5 г сожгли (реакция 1), и было получено 65,1 г смеси оксида углерода (IV) и воды. Количество вещества обоих продуктов сгорания одинаково.
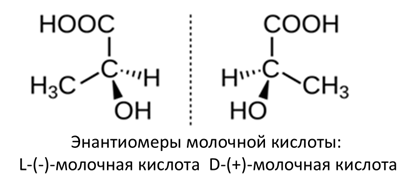
Установлено, что вещество А обладает оптической активностью и является единственным продуктом брожения вещества Q.
На основании данных задачи установите неизвестное вещество А и его структурную формулу (5 баллов, включая энантиомеры).
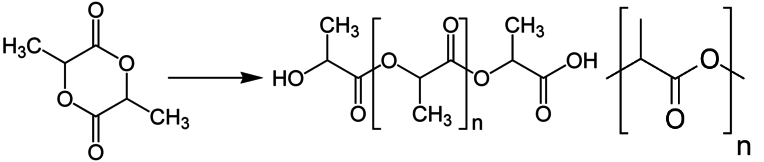
Согласно пояснениям к схеме 1 (рис. 2.1) напишите уравнения реакций органического синтеза с участием вещества А (цепочка превращений 1–10). Назовите все вещества, указанные в синтезе.
- Индустрия производства вещества А на территории Российской Федерации относится к импортозамещению и активно развивается.
- Вещество Q получают крупномасштабным гидролизом возобновляемого сырья (реакция 2).
- Вещество W существует в виде стереоизомеров. Сочетая содержание этих форм, можно конструировать полимеры с различными свойствами (реакция 3). Основное сырье для производства экологической упаковки пищевой продукции.
- Вещество D используется для производства изделий с коротким сроком службы. Ввиду своей биосовместимости, широко используется для производства хирургических нитей, штифтов, систем доставки лекарств (реакция 4).
- Вещество R используется как экологически безопасный «зеленый» растворитель в производстве красителей и покрытий, электронного и оптического оборудования (реакция 5). Обладает оптической активностью.
- Вещество \(\ce{C3H7NO2}\) природного происхождения, компонент средств парентерального питания (реакция 6).
- Вещество U используется в пищевой промышленности в качестве пищевой добавки Е325 как регулятор кислотности, влагоудерживающий агент, эмульгирующая соль, синергист антиоксидантов (реакция 7).
- Вещество G применяется в качестве питания для дрожжей в хлебобулочных изделиях и в качестве отвердителя для фруктов (в консервах) (реакция 8).
- Вещество X является конечным продуктом гликолиза. Результаты клинических испытаний указывают, что вещество X эффективнее салициловой кислоты в лечении акне (реакция 9).
- Вещество Y — универсальный реагент тонкого органического синтеза в производстве фармацевтических препаратов, агрохимикатов и др. Получают при взаимодействии вещества А с сильным хлорирующим реагентом (реакция 10).
- Вещество K имеет молекулярную формулу \(\ce{C3H5NO}\), участвует в синтезе \(\alpha\)-оксикислот и непредельных карбоновых кислот (реакция 11).
| Уравнения и расчеты | Критерии оценивания | |
|---|---|---|
| 1. | Установим количественный состав вещества \(\ce{C_xH_yO_z}\): \[\begin{gather} n{\ce{CO2}} = n{\ce{H2O}} = x\ \text{моль}, \text{ тогда}\\ 44x + 18x = 65,1;\\ x = 1,05\ \text{моль}. \end{gather}\] | 1 балл |
| 2. | \[\begin{gather} n{\ce{CO2}} = n{\ce{C}} = 1,05\ \text{моль};\\ n{\ce{H}} = 2n{\ce{H2O}} = 2,1\ \text{моль};\\ m{\ce{C_{\text{ат}}}} = 1,05 \times 12 = 12,6\ \text{г};\\ m{\ce{H_{\text{ат}}}} = 2,1\ \text{г};\\ n{\ce{O_{\text{ат}}}} \times 16 = m{\text{X}} - m{\ce{C_{\text{ат}}}} - m{\ce{H_{\text{ат}}}} = 31,5 - 12,6 - 2,1 = 16,8\ \text{г};\\ n{\ce{O_{\text{ат}}}} = 1,05\ \text{моль}. \end{gather}\] | 1 балл |
| 3. | \[n \ce{C _{\text{ат}}}: n\ce{H_{\text{ат}}} : n\ce{O_{\text{ат}}} = \frac{12{,}6}{12} : \frac{2{,}1}{1} : \frac{16{,}8}{16} = 1{,}05 : 2{,}1 : 1{,}05 = 1 : 2 : 1 = 3 : 6 : 3;\] \(\ce{C3H6O3}\) — молекулярная формула. | 1 балл |
| 4. |
Структурная формула A — молочная кислота, \(\alpha\)-гидроксипропионовая кислота, 2-гидроксипропановая кислота. |
1 балл |
| 5. |
|
1 балл |
| 6. | Реакция 1:
|
1 балл |
| 7. | Реакция 2:
Q — глюкоза. |
1 балл |
| 8. | Реакция 3:
W — лактид — существуют в виде двух L- и D-стереоизомеров, являющихся зеркальным отображением друг друга. Варьируя относительное содержание этих форм в полилактиде, можно задавать свойства получаемого полимера, а также получать различные классы полилактидных материалов. |
2 балла |
| 9. | Реакция 4:
D — полилактид, используется для производства изделий с коротким сроком службы (пищевая упаковка, одноразовая посуда, пакеты, различная тара). |
2 балла |
| 10. | Реакция 5:
R — этиллактат, этиловый эфир молочной кислоты. |
1 балл |
| 11. | Реакция 6:
Вещество \(\ce{C3H7NO2}\) природного происхождения, компонент средств парентерального питания. |
1 балл |
| 12. | Реакция 7:
U — лактат натрия. |
1 балл |
| 13. | Реакция 8:
G — лактат кальция. |
1 балл |
| 14. | Реакция 9:
X — пировиноградная кислота. |
1 балл |
| 15. | Реакция 10:
Y — 2-хлорпропаноилхлорид, \(\alpha\)-хлорпропионилхлорид. |
1 балл |
| 16. | Реакция 11:
K — 2-гидроксипропиононитрил. Вещество K имеет молекулярную формулу \(\ce{C3H5NO}\). |
1 балл |
| Итого | 20 баллов | |

Ацетат магния имеет богатое «портфолио» в различных областях промышленности: Mg-содержащая добавка в комбикормах, катализатор тонкого органического синтеза, фиксатор при окрашивании текстиля и ситца, удобрение, компонент антигололедных смесей и т. д.
Кристаллогидрат ацетата магния \(\ce{Mg(CH3COO)2*nH2O}\) растворили в 200 мл воды.
Данный раствор прореагировал с 300 мл 1M раствора фосфата натрия (\(\rho = 1{,}1\) г/мл). В полученном растворе молярное соотношение фосфат-ионов к катионам натрия составило \(9:1\). При этом массовая доля ацетат-ионов в полученном растворе составила 6,232%.
Рассчитайте молекулярную формулу исходного кристаллогидрата (процессами гидролиза в расчетах пренебречь).
Соответствует ли данная навеска кристаллогидрата международному стандарту качества Magnesium acetate tetrahydrate extra pure?
- Аналогичную навеску ацетата магния длительно прокалили до постоянного веса; выделившийся газ охладили (н. у.). Данную порцию газообразного продукта смешали с угарным газом в мольном соотношении \(1 : 2\) и ввели в реактор объемом 3 л, в котором уже находился водород, исходная концентрация которого 0,4 моль/л. В результате протекания обратимой реакции в реакционной смеси установилось химическое равновесие. \[\ce{CO_{(r)} + H2O_{(r)} <=> CO2_{(r)} + H2_{(r)}}.\] На момент химического равновесия было обнаружено 23,52 л (н. у.) водорода. Вычислите равновесный объем угарного газа (н. у.).
| Уравнения и расчеты | Критерии оценивания | |
|---|---|---|
| 1. | \[m_{\text{исх р-ра}} = V_{\text{р-р}} \cdot \rho = 300 \cdot 1{,}1 = 330\ \text{г}.\] Исходя из 1M раствора фосфата натрия: \[\begin{gather} n_{\text{исх}}\ce{Na3PO4} = 0,3\ \text{моль};\\ n{\ce{PO4^{3-}}}_{\text{исх}} = 0,3\ \text{моль};\\ n{\ce{Na+}}_{\text{исх}} = 0,9\ \text{моль}. \end{gather}\] | 3 балла |
| 2. | Соединения натрия все растворимы, поэтому мольное соотношение катионов натрия неизменно. Отсюда делаем вывод, что фосфат натрия был в избытке и в конечном растворе имеется: \[\frac{n{\ce{Na+}}}{n{\ce{PO_{4{\text{ост}}}^{3-}}}} = \frac{9}{1} = \frac{0{,}9 \, \text{моль}}{0{,}1 \, \text{моль}}.\] Значит: \[\ce{n\ce{PO4^3-}_{\text{прореаг}}} = 0{,}3 - 0{,}1 = 0{,}2 \, \text{моль}.\] | 3 балла |
| 3. | \[\overset{0{,}3 \, \text{моль}}{\ce{3Mg(CH3COO)2}} + \overset{0{,}2 \, \text{моль}}{\ce{2Na3PO4}}\ce{ -> }\overset{0{,}1 \, \text{моль}}{\ce{Mg3(PO4)2 v}} + \overset{0{,}6 \, \text{моль}}{\ce{6CH3COONa}}.\] | 1 балл |
| 4. | \[\begin{gather} \omega(\ce{CH3COO^-}) = \frac{m_{\ce{CH3COO^-}}}{m_{\text{исх. р-р}} \ce{Mg(CH3COO)2} + m_{\text{исх. р-р}}\ce{Na3PO4} - m{\ce{Mg3(PO4)2}}} \times\\ \times 100 = 6,232\%;\\ \omega(\ce{CH3COO^-}) = \frac{0,6 \cdot 59}{m_{\text{исх р-р}}\ce{Mg(CH3COO)2} + 330 - 0,1 \cdot 262} \cdot 100 = 6,232\%;\\ m_{\text{исх р-р}} \ce{Mg(CH3COO)2} = 264,2\ \text{г}. \end{gather}\] | 3 балла |
| 5. | \[m_{\text{р-ра}} = m_{\text{кр}} + m_{\ce{H2O}} = 264{,}2\ \text{г}; \text{ тогда } m_{\text{кр}} = 64{,}2\ \text{г}.\] | 1 балл |
| 6. | \[M_{\ce{Mg(CH3COO)2*nH2O}} = \frac{m}{n} = 214\ \text{г/моль};\] \[n{\ce{H2O}} = \frac{214 - 142}{18} = 4\ \text{моль}.\] Стандарту качества соответствует. | 1 балл |
| 7. | \[\ce{Mg(CH3COO)2 ->[t] MgCO3 + CH3C(O)CH3};\] \[\ce{MgCO3 ->[t] MgO + CO2 ^}.\] Аналогичная навеска \(n_{\text{исх}}\ce{Mg(CH3COO)2} = 0{,}3\ \text{моль}\). \[n_{\text{доб}}\ce{CO2} = 0{,}3\ \text{моль}.\] | 2 балла |
| 8. | \[\begin{gather} \ce{CO_{(r)} + H2O_{(r)} <=> CO2_{(r)} + H2_{(r)}};\\ C_M \ce{CO}_{2\text{расчетная}} = \frac{n}{V} = \frac{0,3\ \text{моль}}{3\ \text{л}} = 0,1\ \text{моль};\\ n_{\text{равн}}\ce{H2} = \frac{23,52\ \text{л}}{22,4\ \text{л/моль} \cdot 3\ \text{л}} = 0,35\ \text{моль};\\ n_{\text{изменений}}\ce{H2} = 0,4 - 0,35 = 0,05\ \text{моль}. \end{gather}\] | 3 балла |
| 9. | Оксиды углерода (II) и (IV) были взяты в мольном соотношении \(2:1\). \[n_{\text{исх}} \ce{CO} = 0{,}2\ \text{моль}.\] На момент равновесия: \[n_{\text{равн}}\ce{CO} = 0{,}2 + 0{,}05 = 0{,}25\ \text{моль};\] \[V_{\text{равн}} \ce{CO} = 3 \cdot 0{,}25 \cdot 22{,}4 = 16{,}8\ \text{л}.\] | 3 балла |
| Итого | 20 баллов | |
Гидрофосфат натрия используют в качестве буферного агента для поддержания уровня pH в различных растворах в области фармацевтики, химической и пищевой промышленности. Использование гидрофосфата натрия предотвращает коагуляцию при приготовлении сгущенного молока. В порошковых продуктах используется как антислеживающая добавка. В продажу он поступает в виде кристаллогидрата.
Кристаллогидраты — это сложные вещества, которые содержатся в кристаллической решетке молекулы воды; выкристаллизовываются из водных растворов. Например, \(\ce{Na2HPO4.12H2O}\).
Кристаллогидраты легко растворимы в воде, при этом протекают сложные физико-химические процессы, и наблюдается тепловой эффект. Но, если говорить про конечный результат, вещество диссоциирует, а кристаллизационная вода отделяется и попадает в раствор. Условно процесс растворения можно записать в виде: \[\ce{Na2HPO4.12H2O ->[\text{растворение}] Na2HPO4 + 12H2O}.\]
При длительном хранении кристаллогидратов наблюдается постепенное выветривание кристаллизационной воды и нарушается степень чистоты аналитического реактива.
В химической лаборатории при установлении качества реактива навеску смеси выветренного кристаллогидрата массой 39,35 г растворили в воде и получили 400 мл раствора (\(\rho = 1{,}03\) г/мл). При этом поглотилось 8,96 кДж теплоты. Определите массовую долю соли в полученном растворе и исходный состав (по массе) компонентов навески, считая, что после выветривания он состоит только из двенадцативодного кристаллогидрата и безводной соли.
Интегральные теплоты растворения:
\(\Delta H_{\ce{Na2HPO4}} = -25{,}94\) кДж/моль,
\(\Delta H_{\ce{Na2HPO4.12H2O}} = 96{,}06\) кДж/моль.
Для проведения качественного анализа лаборант добавил к полученному раствору порцию нитрата серебра, содержащую количество электронов в 15,6 раза больше числа Авогадро. Хватит ли данной порции для полного осаждения фосфат-ионов?
| Уравнения и расчеты | Критерии оценивания | |
|---|---|---|
| 1. | Пусть исходная смесь содержит \(x\) моль сухой безводной соли и \(y\) моль кристаллогидрата, следовательно, \(m_{\text{смеси}} = 142x + 358y = 39{,}35\) г. | 3 балла |
| 2. | Из условия следует, что при растворении 1 моль сухой соли выделяется 25,94 кДж энергии, а при растворении 1 моль кристаллогидрата поглощается 96,06 кДж. Суммарный тепловой эффект растворения указанного образца равен сумме тепловых эффектов обоих процессов, с учетом количеств веществ, а именно: \((-25{,}94)x + 96{,}06y = 8{,}96\). | 3 балла |
| 3. | Составляем систему уравнений: \[\begin{cases} 142x + 358y = 39{,}35, \\ (-25{,}94)x + 96{,}06y = 8{,}96. \end{cases}\] Решая систему уравнений, получаем: \(x = 0{,}025\) моль; \(y = 0{,}1\) моль. | 4 балла |
| 4. | Отсюда находим состав выветренного кристаллогидрата: \[\begin{gather} m{\ce{Na2HPO4}} \text{ безводн} = 0,025 \cdot 142 = 3,55~\text{г}; \\ m{\ce{Na2HPO4.12H2O}} = 0,1 \cdot 358 = 35,8~\text{г}. \end{gather}\] | 2 балла |
| 5. | Для нахождения \(\omega\) соли в растворе находим массу \(\ce{Na2HPO4}\): \[\begin{gather} m{\ce{Na2HPO4}} \text{ общая}=\ce{Na2HPO4} \text{ безводн}+\ce{Na2HPO4} \text{ кр}=\\= 0,025 \cdot 142 + 0,1 \cdot 142 = 17,75~\text{г}. \end{gather}\] | 1 балл |
| 6. | Масса раствора: \[\begin{gather} m_{\text{раствора}} = 400 \cdot 1,03 = 412~\text{г}; \\ \omega_{\text{соли}} = \frac{17,75}{412} \cdot 100\% = 4,31\%. \end{gather}\] | 1 балл |
| 7. | Реакция 1. \[\begin{gather} n{\ce{Na2HPO4}} \text{ общая} = \frac{17,75}{142} = 0,125~\text{моль}; \\ \ce{Na2HPO4 + 3AgNO3 -> Ag3PO4 v + HNO3 + 2NaNO3}; \\ \frac{n{\ce{Na2HPO4}}}{n{\ce{AgNO3}}} = \frac{1}{3} = \frac{0,125~\text{моль}}{0,375~\text{моль}}. \end{gather}\] | 3 балла |
| 8. | Количество электронов в 15,6 раз больше числа Авогадро: \[\begin{gather} n_e = 15,6~\text{моль}; \\ n_e \ce{AgNO3} = 47 + 7 + 3 \cdot 8 = 78. \end{gather}\] Пусть \(n{\ce{AgNO3}} = x\) моль, тогда \(78x = 15{,}6\). \(n{\ce{AgNO3}} = 0{,}2\) моль. | 2 балла |
| 9. | Данной порции хватает для полного осаждения ионов. | 1 балл |
| Итого | 20 баллов | |

История изучения процессов брожения полна научных открытий. Многие законы и химические знания о биологически активных веществах начинались именно в этой области производства пищевых продуктов.
Как результат окислительно-восстановительных превращений брожение может «подарить» нам полезные продукты, а может их испортить. Его используют в пивоварении, хлебопечении, виноделии и др. В XX веке брожение стали использовать для промышленного получения кислородсодержащих органических соединений.
| Вещество | \(\Delta H_{298}^\circ\) кДж/моль |
|---|---|
| C | \(-393{,}51\) |
| H\(_2\) | \(-285{,}84\) |
| C\(_6\)H\(_{12}\)O\(_6\) | \(-2816{,}0\) |
| C\(_3\)H\(_6\)O\(_3\) | \(-1364{,}0\) |
| C\(_2\)H\(_5\)OH | \(-1366{,}9\) |
| C\(_4\)H\(_8\)O\(_2\) | \(-2193{,}1\) |
| C\(_6\)H\(_8\)O\(_7\) | \(-1985{,}3\) |
Приведите примеры брожения (не менее четырех).
В ходе какого процесса выделяется больше теплоты? Рассчитайте тепловые эффекты реакций брожения при стандартных условиях, используя стандартные теплоты сгорания веществ, приведенные в таблице 1.1.
Приведите термохимические уравнения реакций горения веществ, необходимых для проведения расчетов.
Рассчитайте температуру в реакторе спиртового брожения через 10 ч в закрытой системе, если для процесса взяли 10 л 10%-го раствора глюкозы при начальной температуре 20 °C. Скорость образования спирта примите постоянной 0,47 об.% в час. За основу взять теплоемкость воды, изменением массы и объема можно пренебречь.
Удельная теплоемкость воды 4200 Дж/(кг·°C).
Плотность этанола 0,79 г/мл.
| Уравнения и расчеты | Критерии оценивания | |
|---|---|---|
| 1. | Уравнение 1. \(\ce{C6H12O6 + 6O2 -> 6CO2 + 6H2O}\); \(\Delta H_1 = -2816{,}0\) кДж. Уравнение 2. \(\ce{C3H6O3 + 3O2 -> 3CO2 + 3H2O}\); \(\Delta H_2 = -1364{,}0\) кДж. Уравнение 3. \(\ce{C4H8O2 + 5O2 -> 4CO2 + 4H2O}\); \(\Delta H_3 = -2193{,}1\) кДж. Уравнение 4. \(\ce{2C6H8O7 + 9O2 -> 12CO2 + 8H2O}\); \(\Delta H_4 = -3970{,}6\) кДж. Уравнение 5. \(\ce{H2 + 0.5O2 -> H2O}\); \(\Delta H_5 = -285{,}84\) кДж. Уравнение 6. \(\ce{C2H6O + 3O2 -> 2CO2 + 3H2O}\); \(\Delta H_6 = -1366{,}9\) кДж. |
3 балла |
| 2. | Приведите примеры брожения (не менее четырех). Спиртовое \(\ce{C6H12O6 -> 2CO2 + 2C2H5OH}\). Молочнокислое \(\ce{C6H12O6 -> C3H6O3}\). Маслянокислое \(\ce{C6H12O6 -> 2CO2 + 2H2 + C4H8O2}\). Лимоннокислое \(\ce{2C6H12O6 + 3O2 -> 2C6H8O7 + 4H2O}\). |
4 балла |
| 3. | Молочно-кислое брожение Уравнение 1. \(\ce{C6H12O6 + 6O2 -> 6CO2 + 6H2O}\); \(\Delta H_1 = -2816{,}0\) кДж. Уравнение 2. \(\ce{C3H6O3 + 3O2 -> 3CO2 + 3H2O}\); \(\Delta H_2 = -1364{,}0\) кДж. Из комбинации двух уравнений получается уравнение брожения. Следовательно, тепловой эффект реакции молочнокислого брожения: \(\Delta H_{\text{брожения}} = \Delta H_1 - 2 \cdot \Delta H_2 = -2816{,}0 - 2 \cdot (-1364{,}0) = -136\) кДж. |
2 балла |
| 4. | Маслянокислое брожение Уравнение 1. \(\ce{C6H12O6 + 6O2 -> 6CO2 + 6H2O}\); \(\Delta H_1 = -2816{,}0\) кДж. Уравнение 3. \(\ce{C4H8O2 + 5O2 -> 4CO2 + 4H2O}\); \(\Delta H_3 = -2193{,}1\) кДж. Уравнение 5. \(\ce{H2 + 0,5O2 -> H2O}\); \(\Delta H_5 = -285{,}84\) кДж. Из комбинации трех уравнений получается уравнение брожения: \(\Delta H_{\text{брожения}} = \Delta H_1 - \Delta H_3 - 2 \cdot \Delta H_5 = -2816{,}0 - (-2193{,}1) - 2 \cdot (-285{,}84) = -51{,}22\) кДж. |
2 балла |
| 5. | Лимоннокислое брожение Уравнение 1. \(\ce{C6H12O6 + 6O2 -> 6CO2 + 6H2O}\); \(\Delta H_1 = -2816{,}0\) кДж. Уравнение 4. \(\ce{2C6H8O7 + 9O2 -> 12CO2 + 8H2O}\); \(\Delta H_4 = -3970{,}6\) кДж. Из комбинации двух уравнений получается уравнение брожения: \(\Delta H_{\text{брожения}} = 2 \cdot \Delta H_1 - \Delta H_4 = 2 \cdot (-2816{,}0) - (-3970{,}6) = -1661{,}4\) кДж. |
2 балла |
| 6. | Тепловой эффект спиртового брожения: \(\ce{C6H12O6 -> 2CO2 + 2C2H5OH}\) получим аналогично всем процессам комбинацией следующих уравнений: Уравнение 1. \(\ce{C6H12O6 + 6O2 -> 6CO2 + 6H2O}\); \(\Delta H_1 = -2816{,}0\) кДж; Уравнение 6. \(\ce{C2H6O + 3O2 -> 2CO2 + 3H2O}\); \(\Delta H_6 = -1366{,}9\) кДж. Из комбинации двух уравнений получается уравнение брожения: \(\Delta H_{\text{брожения}} = \Delta H_1 - 2 \cdot \Delta H_6 = -2816 - (-1366{,}9) \cdot 2 = -82{,}2\) кДж. |
2 балла |
| 7. | Согласно скорости образования в час получается \(V_{\text{этанола}} = \varphi \cdot V_{\text{раствора}} = 0{,}0047 \cdot 10~\text{л} = 0{,}047\) л. За 10 ч образуется 0,47 л. Масса полученного спирта: \(m_{\text{этанола}} = 470~\text{мл} \cdot 0{,}79~\text{г/мл} = 371{,}3\) г. Количество вещества: \(n = \dfrac{m}{M_{\text{этанола}}} = \dfrac{371{,}3}{46} = 8\) моль. По уравнению брожения на 2 моль образующегося спирта выделяется 82,2 кДж энергии, соответственно на 8 моль — будет \(82{,}2 \cdot 8 = 657{,}6\) кДж. Выделяющаяся теплота будет поглощаться водой. \[Q = m \cdot c \cdot (t_2 - t_1);\] \[657600 = 10~\text{кг} \cdot 4200~\text{Дж/(кг·$°$C)} \cdot (t_2 - 20~°\text{C});\] \[t_2 = 35{,}66~°\text{C}.\] |
5 баллов |
| Итого | 20 баллов | |
Антисептическое действие перекиси водорода обусловлено оксидантным эффектом и создает неблагоприятные условия для развития микроорганизмов, особенно анаэробной и гнилостной флоры; вместе с тем оно характеризуется малой продолжительностью и слабой выраженностью эффекта. Ее растворы применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией и упаковки молочной продукции и соков.
Порцию неизвестного щелочного металла массой 13,8 г окислили кислородом (вещество А). Полученный остаток массой 21,8 г растворили в горячей воде. При этом выделилось 2,24 л газа (н. у.). Образовавшийся раствор нейтрализовали 146 г раствора c массовой долей 15% соляной кислоты. Какой металл подвергнут окислению? Запишите уравнения реакций, упомянутых в задаче. Вычислите массовые доли продуктов окисления металла.
Вещество А, обладающее окислительно-восстановительными свойствами, выделили и ввели в следующие неорганические синтезы:
- Перекись водорода — прозрачная бесцветная жидкость без запаха или со слабым своеобразным запахом, слабокислой реакции. Ее можно получить на холоде по реакции 1.
- Раствор, полученный по реакции 1, частично выпарили и добавили навеску иодида натрия в недостатке. В данной системе наблюдалось последовательное выпадение и растворение осадка с образованием бесцветного раствора (реакции 2–3).
- Одно из веществ, полученных в реакции 1, прореагировало с гипохлоритом кальция. Наблюдалось выделение газа без запаха (реакция 4).
- Вещество А (из расчетной задачи) может реагировать с сернистым ангидридом с образованием соли Б (реакция 5). Такая же соль образуется, если вещество А реагирует с подкисленным раствором сульфата железа (II) (реакция 6).
- При реагировании вещества А с серой образуется два сложных вещества (реакция 7).
| Уравнения и расчеты | Критерии оценивания | |
|---|---|---|
| 1. | По уравнению реакции нейтрализации определим металл: \[\begin{gather} \ce{MeOH + HCl -> MeCl + H2O};\\ m_{\ce{HCl}} = 146 \cdot 0,15 = 21,9~\text{г};\\ n{\ce{HCl}} = \frac{21,9}{36,5} = 0,6~\text{моль}; \\ n{\ce{HCl}} = n{\ce{MeOH}} = 0,6~\text{моль}; \\ M_{\ce{Me}} = \frac{13,8}{0,6} = 23~\text{г/моль}. \end{gather}\] Это натрий \(\ce{Na}\). | 4 балла |
| 2. | \[\ce{NaOH + HCl -> NaCl + H2O}.\] | 1 балл |
| 3. | \[\ce{2Na + O2 -> Na2O2}.\] | 1 балл |
| 4. | \[\ce{Na2O2 + 2Na -> 2Na2O}.\] | 1 балл |
| 5. | \[\ce{2Na2O2 + 2H2O ->[t] 4NaOH + O2}.\] | 1 балл |
| 6. | \[\ce{Na2O + H2O ->[t] 2NaOH}.\] | 1 балл |
| 7. | Газ — это , \(n{\ce{O2}} = 0{,}1\) моль. \[\ce{2Na2O2 + 2H2O ->[t] 4NaOH + O2};\] \[m{\ce{Na2O2}} = 78 \cdot 0{,}2 = 15{,}6~\text{г}.\] | 2 балла |
| 8. | \[m{\ce{Na2O}} = 21{,}8 - 15{,}6 = 6{,}2~\text{г};\] \[n{\ce{Na2O}} = \frac{6{,}2}{62} = 0{,}1~\text{моль}.\] | 1 балл |
| 9. | \[\omega{\ce{Na2O}} = \frac{6{,}2}{21{,}8} \cdot 100\% = 28{,}44\%;\] \[\omega{\ce{Na2O2}} = \frac{15{,}6}{21{,}8} \cdot 100\% = 71{,}56\%.\] | 1 балл |
| 10. | Реакция 1: \[\ce{Na2O2 + 2H2O ->[\text{холод}] 2NaOH + H2O2}.\] | 1 балл |
| 11. | Реакция 2: \[\ce{H2O2 + 2NaI -> I2 + 2NaOH}.\] | 1 балл |
| 12. | Реакция 3: \[\ce{3H2O2 + NaI ->[\text{щелочная среда}] NaIO3 + 3H2O}.\] | 1 балл |
| 13. | Реакция 4: \[\ce{2H2O2 + Ca(ClO)2 -> CaCl2 + 2O2 ^ + 2H2O}.\] | 1 балл |
| 14. | Реакция 5: \[\ce{Na2O2 + SO2 -> Na2SO4}.\] | 1 балл |
| 15. | Реакция 6: \[\ce{Na2O2 + 2H2SO4 + 2FeSO4 -> Fe2(SO4)3 + Na2SO4 + 2H2O}.\] | 1 балл |
| 16. | Реакция 7: \[\ce{3Na2O2 + S -> Na2SO4 + 2Na2O}.\] | 1 балл |
| Итого | 20 баллов | |