Предметный тур. Химия. 3 этап
Предлагаем ответить на вопросы, приведенные ниже, — они посвящены химическим элементам, входящим в состав полезных материалов. Ответы на них «спрятаны» в матрице на рис. 1.1: слова могут располагаться горизонтально и вертикально, размещаться слева направо \(\rightarrow\), справа налево \(\leftarrow\), сверху вниз \(\downarrow\) и снизу вверх \(\uparrow\), а также пересекаться.
- Этот неметалл образует множество аллотропных модификаций, которые находят разнообразное применение: для изготовления электродов и как замедлитель нейтронов; для резки стекла и изготовления буров; в качестве материала фотоэлементов и для адресной доставки лекарственных препаратов...
- Этот металл, являющийся самым распространенным в земной коре, уже давно в числе лидеров материалов аэрокосмической отрасли благодаря прочности, стойкости к коррозии и легкости. Но получение композитов за счет армирования различными волокнами позволяет сделать его свойства еще лучше!
- Благодаря рекордной электропроводности этот металл стал ключевым материалом для сверхпроводниковых квантовых процессоров и гибких печатных плат.
- Простое вещество, образуемое этим элементом, входит в состав атмосферы и используется для охлаждения сверхпроводников, а некоторые из его бинарных соединений являются сверхтвердыми термостойкими материалами — из них изготавливают режущие инструменты и абразивные покрытия.
- Сплавы этого легкого металла, 1 атом которого весит \(1{,}50\cdot 10^{-23}\) г, применяют как конструкционные материалы в авиа- и ракетостроении — они обладают и высокой прочностью, и, в отличие от аналогов, высокой жесткостью. В частности, из такого сплава изготовлены детали системы торможения космического корабля «Буран».
- Рабочим телом манометров, полярографов, барометров и ряда других измерительных приборов должна быть высокоплотная тепло- и электропроводящая жидкость, благодаря чему на эту роль идеально подошел данный металл.
- Катализаторы на основе этого металла широко используются в процессах нефтепереработки для гидроочистки бензиновых и дизельных фракций, а также в синтезе изопрена, формальдегида, акрилонитрила, стирола.
- Радиоактивный изотоп этого элемента используется в производстве источников гамма-излучения для радиохирургии, стерилизации пищевых продуктов и медицинских инструментов, обеззараживания сточных вод. Распад нуклида сопровождается выделением электрона и ядра из 28 протонов и 32 нейтронов.
- Соединения этого металла окрашены в разные цвета, что повлияло и на его название. Его темно-синий оксид, содержащий 61,4% масс. металла, обладает удивительным свойством — быстро «переключаться» между полупроводниковым и проводниковым состоянием — благодаря чему может применяться в нейроморфных компьютерах, «умных» метаматериалах и сенсорах.
- Минимальная энергия, необходимая для удаления единственного электрона внешней оболочки этого металла золотисто-белого цвета, мала, благодаря чему из него производят высокочувствительные фотоэлементы и фотоумножители.
- Этот благородный газ используется в качестве активной среды в лазерах, применяющихся в офтальмологии, косметической медицине и материалообработке.
Задания:
- Перепишите слова в лист ответов в формате «номер — слово».
Ответьте на дополнительные вопросы:
- Приведите не менее трех примеров аллотропных модификаций элемента из п. 1.
- Приведите формулу бинарного соединения элемента из п. 4, если известно, что оно является изоэлектронным углероду и по твердости приближается к алмазу.
- Подтвердите расчетом элемент п. 5.
- Что такое «катализатор»?
- Приведите уравнение реакции, описанной в п. 8.
- Приведите формулу оксида, упомянутого в п. 9. Подтвердите расчетом.
Слова, зашифрованные в филворде:
- углерод,
- алюминий,
- медь,
- азот,
- бериллий,
- ртуть,
- молибден,
- кобальт,
- ванадий,
- цезий,
- криптон.
Ответы на дополнительные вопросы:
- Модификации углерода включают: графит, алмаз, фуллерены, карбин, графен, нанотрубки, лонсдейлит, аморфный углерод и т. д. (оценивается 3 ответа).
- Изоэлектронным углероду соединением бинарным соединением азота является нитрид бора \(\ce{BN}\).
- Молярная масса элемента п. 5: \[n = \frac{N}{N_A} = \frac{m}{A_r}; \quad A_r = \frac{m}{N} N_A = \frac{1.50e-23}{1} \cdot 6.02e23 = 9 \text{ г/моль}, \text{ бериллий}.\]
- Катализатор — вещество, участвующее в реакции и изменяющее ее скорость, но остающееся неизменным после того, как химическая реакция заканчивается (принимаются любые разумные определения).
- \(\ce{^{60}_{27}Co -> ^{60}_{28}Ni + ^{0}_{-1}e}\) (указание дополнительно антинейтрино и гамма-кванта оценивается полным баллом).
- Формула оксида \(\ce{VO2}\). Массовая доля кислорода п. 6: \[\omega = \frac{A_r(V)}{A_r(V) + 2 \cdot A_r(O)} = \frac{51}{51 + 2 \cdot 16} = 61{,}4\%.\]
- Названия элементов по 2 балла: 22 балла
Ответы на вопросы: 8 баллов
- A: три модификации по 0,5 балла;
- B, D, E: ответы по 1,5 балла;
- С, F: ответы по 1 баллу
ИТОГО: 30 баллов
При охлаждении дизельное топливо густеет и превращается в желеобразную массу — дело в том, что содержащиеся в нем линейные молекулы парафинов (алканов) имеют высокие температуры плавления и кристаллизуются. Топливный фильтр не справляется с перекачкой такой массы — двигатель теряет мощность и может «заглохнуть», — поэтому крайне актуальной задачей является производство межсезонного, зимнего и арктического топлива.
Одним из способов производства такого топлива является процесс карбамидной депарафинизации: к нефтепродукту добавляют карбамид, линейные парафины связываются с ним в нерастворимый комплекс, который отфильтровывают.
- Установите простейшую формулу карбамида, если известно, что он содержит по массе 20,00% углерода, 46,65% азота, 26,64% кислорода, остальное — водород. В каких сферах еще применяется это вещество?
Алканы имеют общую формулу \(\ce{C_nH_{2n+2}}\). Определите формулу алкана, если известно, что плотность его паров составляет 2,59 г/л (приведено к н. у.).
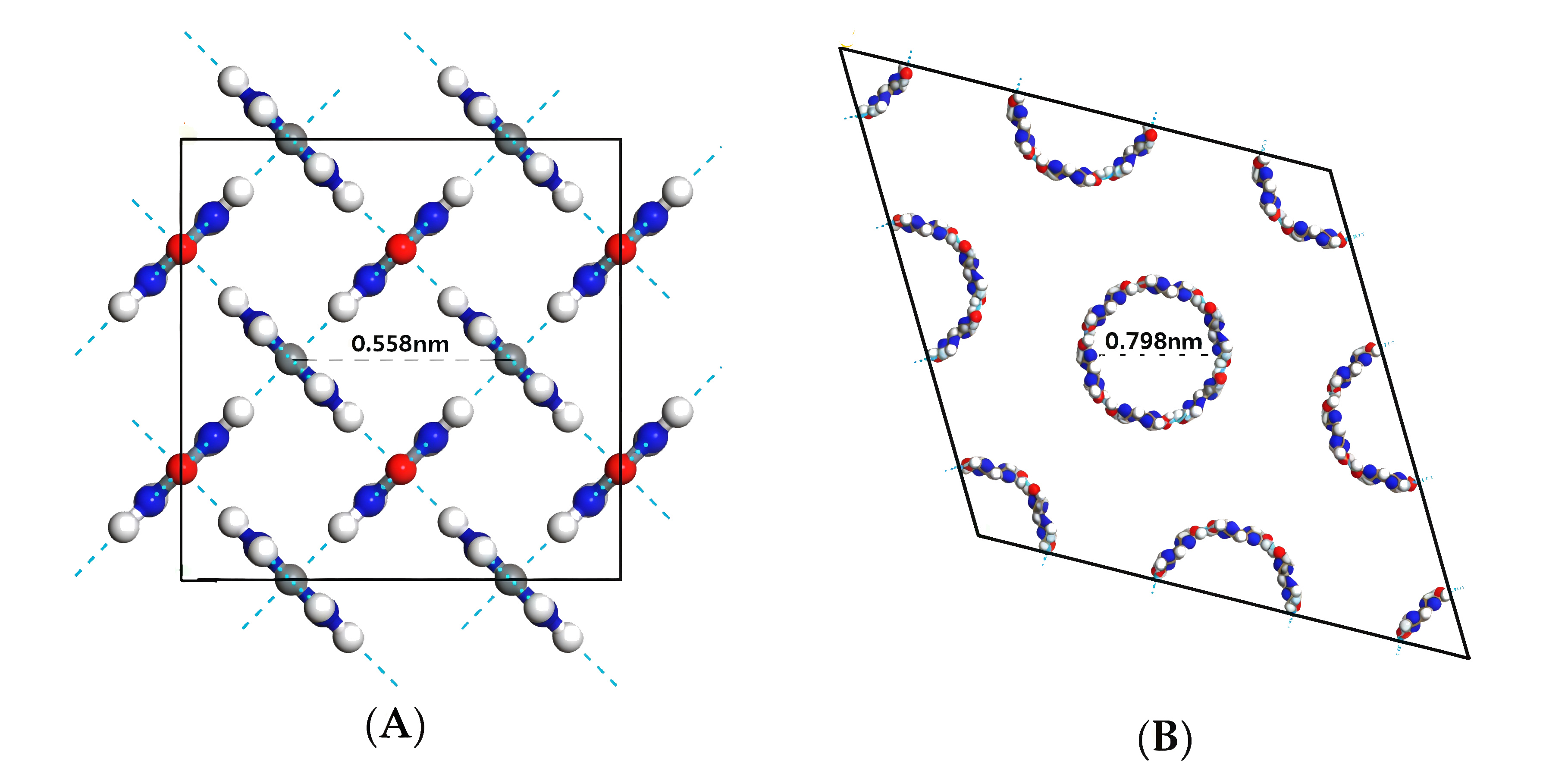
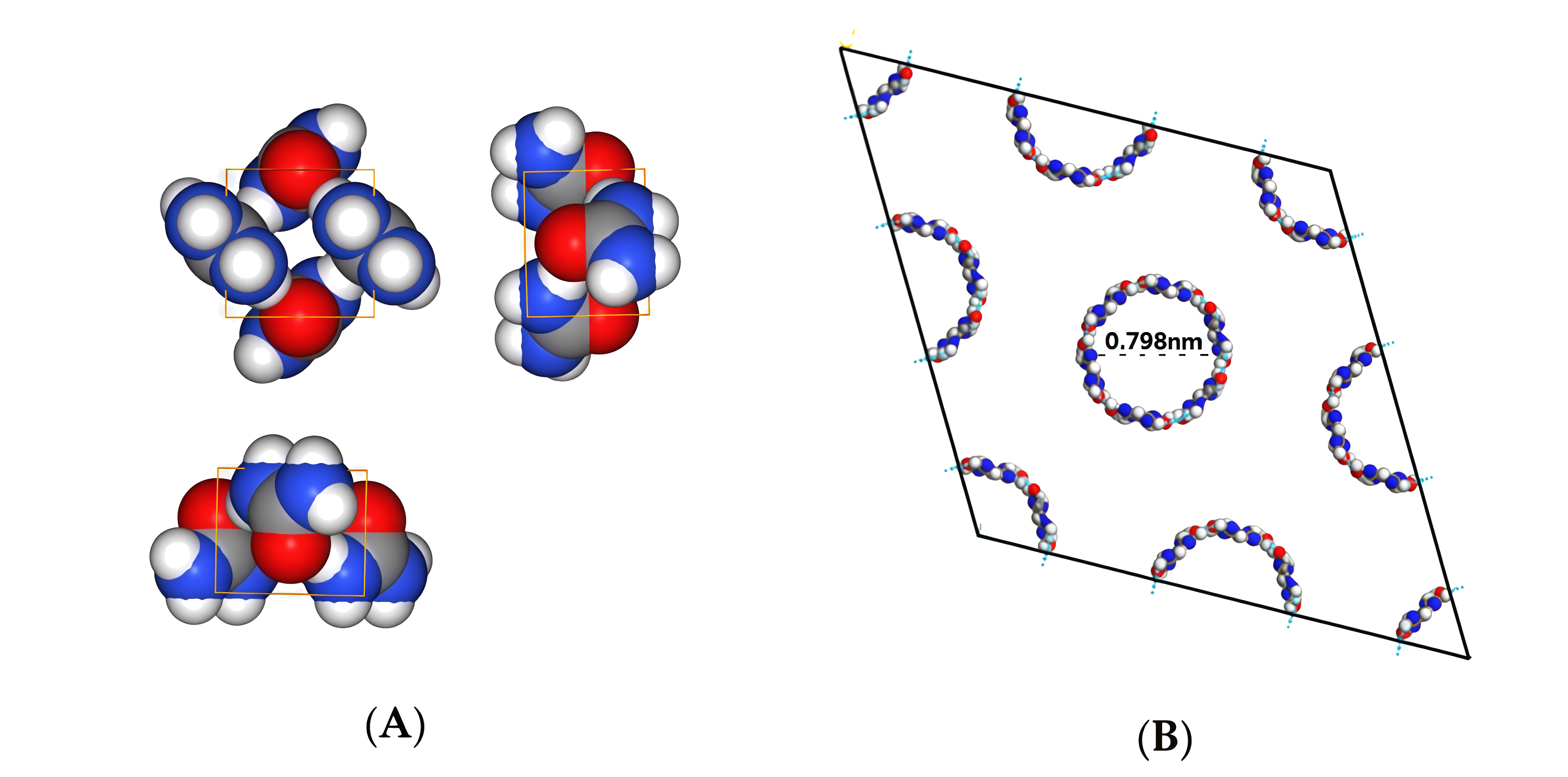
Рис. 1.3.Чистый карбамид имеет тетрагональную кристаллическую структуру (А, рис. 1.3), каждая элементарная ячейка которой представляет собой параллелепипед со сторонами \(a = b = 0{,}566\) нм, \(c = 0{,}471\) нм и включает две молекулы — в такой плотной решетке отсутствуют полости для размещения молекул другого вещества (на рисунке изображено несколько элементарных ячеек). При образовании комплекса с парафином кристаллическая структура карбамида меняется с тетрагональной (А) на гексагональную (В): в такой структуре молекулы карбамида образуют спиралевидные каналы, в которые входят молекулы парафина.
- Рассчитайте плотность карбамида, кг/м\(^3\), имеющего тетрагональную структуру, если молярная масса карбамида составляет 60 г/моль.
Рассчитайте, сколько молекул мочевины приходится на 1 молекулу тетрадекана \(\ce{C14H30}\) в комплексе, если массовая доля углерода в нем составляет 34,97%.
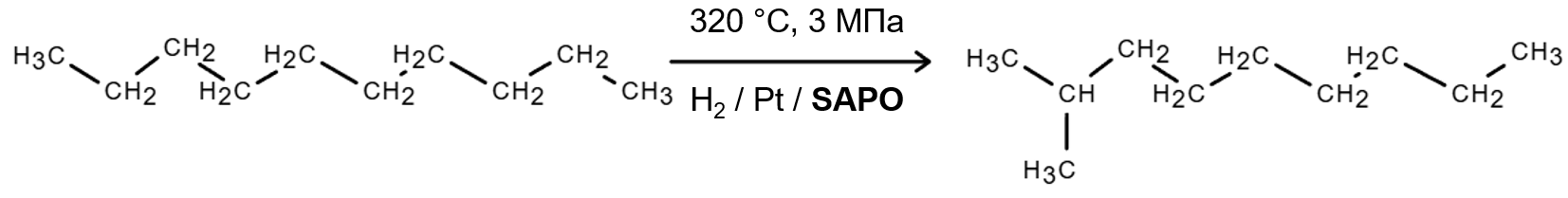
Удаление линейных парафинов приводит к снижению цетанового числа топлива и его выхода, поэтому сейчас на замену этому способу приходит каталитическая изодепарафинизация — в ходе этого процесса легкозастывающие линейные парафины превращаются в низкозастывающие разветвленные парафины.
Уфимские ученые использовали для этой цели платину на силикоалюмофосфатах SAPO. Благодаря полученным результатам, в Институте нефтехимии и катализа Уфимского федерального исследовательского центра РАН (входит в Евразийский научно-образовательный центр) открыли молодежную лабораторию молекулярно-ситовых бифункциональных каталитических систем для получения низкозастывающих дизельных топлив.
Силикоалюмофосфатный гель SAPO исследователи синтезировали следующим образом: к 6,0 мл 85% ортофосфорной кислоты (1,67 г/мл) приливали 35,6 мл дистиллированной воды, в полученный раствор добавляли 5,7 г псевдобемита, содержащего 78% оксида алюминия по массе, интенсивно перемешивали, затем в образовавшийся гель приливали 4,4 г ди-н-пропиламина (вспомогательное вещество) и вводили 2,0 г золя, содержащего 40% по массе диоксида кремния. После добавления всех компонентов полученный гель интенсивно перемешивали, выдерживали в термостате при 90 °C в течение суток и подвергали кристаллизации при 200 °C в течение 24 ч.
Проанализируйте представленную методику синтеза SAPO и опишите его состав в виде \(\ce{xAl2O3.yP2O5.zSiO2}\). Приведите расчеты.
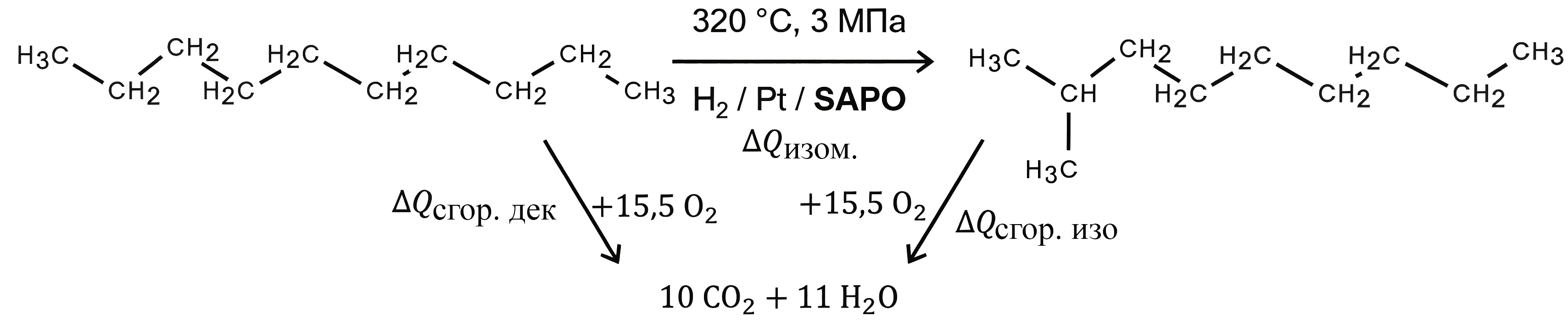
Уравнение протекающей реакции изомеризации может быть представлено как на рис. 1.4.
Рис. 1.4.- Напишите для приведенного алкана уравнение реакции полного сгорания.
- Рассчитайте теплоты сгорания линейного и изоалкана в килоджоулях на моль, если при полном сжигании 50,0 мл углеводородов выделяется 241,8 кДж и 240,1 кДж соответственно. Плотность углеводородов принять 0,73 г/мл.
- Рассчитайте тепловой эффект реакции изомеризации. Как процесс изодепарафинизации влияет на теплотворную способность топлива?
Найдем массовую долю водорода: \[\%H = 100 - (20{,}00 + 46{,}65 + 26{,}64) = 6{,}71\%.\] Примем массу образца за 100 г: \[m_C = 20{,}00 \text{ г}, \quad m_N = 46{,}65 \text{ г}, \quad m_O = 26{,}64 \text{ г}, \quad m_H = 6{,}71 \text{ г}.\] Количество вещества для каждого элемента составит: \[n_C = \frac{20{,}00}{12} \approx 1{,}667 \text{ моль}, \quad n_N = \frac{46{,}65}{14} \approx 3{,}332 \text{ моль},\] \[n_O = \frac{26{,}64}{16} \approx 1{,}665 \text{ моль}, \quad n_H = \frac{6{,}71}{1} = 6{,}71 \text{ моль}.\] Таким образом, простейшее соотношение атомов: \[C : N : O : H = \frac{1{,}667}{1{,}665} : \frac{3{,}332}{1{,}665} : \frac{1{,}665}{1{,}665} : \frac{6{,}71}{1{,}665} \approx 1 : 2 : 1 : 4.\] Это отвечает формуле \(\ce{CH4N2O}\) или \(\ce{(NH2)2CO}\).
Карбамид (мочевина) также используется как азотное удобрение, компонент смол, в производстве пластмасс и лаков.
- Плотность газа при н. у. связана с молярной массой по формуле: \(\rho = \dfrac{M}{V_m}\). Тогда \[M = \rho \cdot V_m = 2{,}59 \text{ г/л} \cdot 22{,}4 \text{ л/моль} \approx 58 \text{ г/моль}.\] Отсюда \[M(\ce{C_nH_{2n+2}}) = 12n + 1 \cdot (2n + 2) = 12n + 2n + 2 = 14n + 2, \text{ то есть } n = 4,\] это \(\ce{C4H10}\).
- Плотность — это отношение массы ячейки к ее объему: \(\rho = \dfrac{m_{\text{яч}}}{V_{\text{яч}}}\). \[V_{\text{яч}} = a \cdot b \cdot c = a^2 \cdot c \text{ (так как } a = b);\] \[V_{\text{яч}} = (0{,}566 \cdot 10^{-9})^2 \cdot 0{,}471 \cdot 10^{-9} = 0{,}151 \cdot 10^{-27} \text{ м}^3 \approx 1{,}51 \cdot 10^{-28} \text{ м}^3.\] В ячейке содержится две молекулы карбамида. Масса одной молекулы: \[m_{\text{мол}} = \frac{M}{N_A} = \frac{0{,}060}{6{,}022 \cdot 10^{23}} \approx 9{,}96 \cdot 10^{-26} \text{ кг}.\] Тогда масса ячейки \[m_{\text{яч}} = 2 \cdot m_{\text{мол}} = 2 \cdot 9{,}96 \cdot 10^{-26} \approx 1{,}99 \cdot 10^{-25} \text{ кг}.\] \[\rho = \frac{m_{\text{яч}}}{V_{\text{яч}}} = \frac{1{,}99 \cdot 10^{-25}}{1{,}51 \cdot 10^{-28}} \approx 1318 \text{ кг/м}^3.\]
- Обозначим число молекул мочевины на 1 молекулу тетрадекана в комплексе \(n\). Тогда \[M_{\ce{(NH2)2CO}} = 12 + 4 + 28 + 16 = 60~ \text{г/моль},\] \[M_{\ce{C14H30}} = 14 \cdot 12 + 30 = 198 ~\text{г/моль},\] массовая доля углерода составит: \[\omega(\ce{C}) = \frac{m_C}{n \cdot M_{\ce{(NH2)2CO}} + M_{\ce{C14H30}}} = \frac{n \cdot 12 + 168}{n \cdot 60 + 198} = 0{,}3497,\] откуда \(n = 11\), то есть комплекс имеет состав \(\ce{C14H30.11(NH2)2CO}\).
Масса раствора фосфорной кислоты: \[m_{\ce{H3PO4}} = 6{,}0 \text{ мл} \cdot 1{,}67 \text{ г/мл} = 10{,}02 \text{ г},\] тогда \[m_{\ce{H3PO4}} = 10{,}02 \text{ г} \cdot 0{,}85 = 8{,}517 \text{ г},\] что соответствует \[n_{\ce{H3PO4}} = \frac{m_{\ce{H3PO4}}}{M_{\ce{H3PO4}}} = \frac{8{,}517}{98} = 0{,}0869 \text{ моль},\] в пересчете на оксид \(\ce{P2O5}\) \(\dfrac{0{,}0869}{2} = 0{,}04345 \text{ моль}\).
Масса оксида алюминия \(m_{\ce{Al2O3}} = 5{,}7 \cdot 0{,}78 = 4{,}446 \text{ г}\), \[n_{\ce{Al2O3}} = \frac{m_{\ce{Al2O3}}}{M_{\ce{Al2O3}}} = \frac{4{,}446}{102} = 0{,}0436 \text{ моль}.\] Масса \(\ce{SiO2}\): \(m_{\ce{SiO2}} = 2{,}0 \cdot 0{,}40 = 0{,}8 \text{ г}\), \[n_{\ce{SiO2}} = \frac{m_{\ce{SiO2}}}{M_{\ce{SiO2}}} = \frac{0{,}8}{60} = 0{,}0133 \text{ моль}.\] Таким образом, состав SAPO: \[\ce{Al2O3} : \frac{0{,}0436}{0{,}04345} \approx 1{,}00, \quad \ce{P2O5} : \frac{0{,}04345}{0{,}04345} = 1{,}00, \quad \ce{SiO2} : \frac{0{,}0133}{0{,}04345} \approx 0{,}306,\] что отвечает \[1{,}0 \ce{Al2O3} \cdot 1{,}0 \ce{P2O5} \cdot 0{,}3 \ce{SiO2}\] или \[3{,}3 \ce{Al2O3} \cdot 3{,}3 \ce{P2O5} \cdot 1{,}0 \ce{SiO2}.\]
- \(\ce{2C10H22 + 31O2 -> 20CO2 + 22H2O}\).
- Масса углеводородов \[m = \rho \cdot V = 0{,}73 \text{ г/мл} \cdot 50{,}0 \text{ мл} = 36{,}5 \text{ г},\] что отвечает \[n_{\ce{C10H22}} = \frac{m_{\ce{C10H22}}}{M_{\ce{C10H22}}} = \frac{36{,}5}{10 \cdot 12 + 22 \cdot 1} \approx 0{,}257 \text{ моль}.\] Таким образом, теплоты сгорания \[\Delta Q_{\text{сгор.дек}} = \frac{Q_{\text{дек}}}{n} = \frac{241{,}8}{0{,}257} \approx 941 \text{ кДж/моль};\] \[\Delta Q_{\text{сгор.изо}} = \frac{Q_{\text{изо}}}{n} = \frac{240{,}1}{0{,}257} \approx 934 \text{ кДж/моль}.\]
К описанной реакции можно применить термохимический цикл, в соответствии с законом Гесса, согласно которому тепловой эффект реакции в изобарных условиях не зависит от пути ее протекания, рис. 1.5.
Рис. 1.5.Отсюда \[\Delta Q_{\text{изом.}} = \Delta Q_{\text{сгор.дек}} - \Delta Q_{\text{сгор.изо}} = 941 - 934 = 7 \text{ кДж/моль}.\]
Видно, что теплота сгорания изоалкана ниже — следовательно, процесс изодепарафинизации снижает теплотворную способность топлива, при этом понижая его температуру застывания.
- Расчет формулы — 2 балла, применение (достаточно одного варианта) — 1 балл: 3 балла
- Расчет алкана: 3 балла
- Расчет плотности: 4 балла
- Расчет состава комплекса: 4 балла
- Расчет состава SAPO: 4 балла
- Уравнение реакции (неверные коэффициенты — 1 балл): 2 балла
- Расчет теплот сгорания — по 3 балла: 6 баллов
Расчет теплоты реакции изомеризации — 3 балла; указание на понижение теплотворной способности топлива — 1 балл: 4 балла
ИТОГО: 30 баллов
Химическому турнирному движению посвящается
Юный химик Тагир участвовал в химическом турнире, и команда поручила ему интересную экспериментальную задачу:
«Одним из методов получения водорода является реакция алюминия с водным раствором сульфата металла М и хлорида натрия. Какие еще методы получения водорода в лаборатории вы знаете? Определите экспериментально, как зависит скорость выделения водорода в описанной системе от концентрации солей. Какие еще факторы оказывают влияние на скорость выделения водорода в данной системе? Объясните наблюдаемые эффекты, приведите схему химических реакций. Растворы каких еще солей могут реагировать с алюминием с быстрым выделением водорода и почему?»
Тагир вспомнил про метод получения водорода растворением алюминия в соляной кислоте (1) и натриевой щелочи (2).
- Напишите уравнения реакций 1–2.
- Какой максимальный объем водорода (н. у.) можно получить из 1,00 г алюминия? Какой объем 15%-го раствора соляной кислоты для этого потребуется?
Какая специализированная посуда может быть использована для получения водорода в лаборатории?
Тагир привел следующую схему протекающих реакций.
Снятие оксидной пленки с алюминия: \[\ce{\textbf{M}^{2+} + H2O -> \ldots + H+};\] \[\ldots + \ldots \ce{ -> }\ldots + \ce{H2O}.\]
Генерация водорода: \[\ldots + \ce{H2O} \ce{ -> }\ldots + \ldots;\] \[\ldots + \ce{H+} \ce{ -> } \ldots + \ldots\]
Параллельный процесс: \[\ldots + \ce{\textbf{M}^{2+}} \ce{ -> } \ldots + \ce{Al^{3+}}.\]
 Рис. 1.7.
Рис. 1.7.При полном растворении алюминия остается оранжево-коричневая взвесь и темно-зеленый раствор (В). Спустя два дня, безвылазно проведенных в лаборатории, ЮХ закончил исследования.
 Рис. 1.8.
Рис. 1.8.Как и все юные химики, Тагир не помыл за собой посуду, а когда случайно заглянул в лабораторию через неделю, то с удивлением заметил, что в оставшейся после реакции колбе раствор (р-р А) обесцветился (3). Балуясь, ЮХ прилил к пробе А избыток раствора аммиака, ожидая появления сине-фиолетовой окраски, однако раствор остался бесцветным (4). Тогда к другой пробе он по каплям добавил раствор гидроксида натрия, наблюдая приведший его в недоумение желтый осадок вещества Б (изображено на рис. 1.9) (5). Зато Тагир сразу догадался обо всем, когда заметил выделение белой мути при добавлении к пробе А избытка воды (6). При этом в соляной кислоте белая муть растворялась, снова образуя прозрачный раствор. При добавлении к нему гипохлорита натрия раствор становится темно-зеленым, как раствор В (7). Желая проверить свою догадку, ЮХ быстро отфильтровал осадок Б и добавил к нему разбавленной серной кислоты при нагревании, удовлетворенно наблюдая образование небольшого количества красного осадка (8), масса которого после тщательной просушки составила 0,234 г. Раствор, образовавшийся при реакции Б с кислотой, был разбавлен в мерной колбе объемом 200 мл, а к аликвоте (25,0 мл) полученного раствора ЮХ добавил 5 мл 1М иодида калия (9), после чего оттитровал 0,10664 М раствором тиосульфата натрия (10). Средний объем затраченного титранта составил 4,3 мл.
 Рис. 1.9.
Рис. 1.9.- Заполните пропуски в схеме. Какими веществами обусловлены визуальные эффекты после завершения реакции?
- Предположите, влияние каких факторов на скорость выделения водорода, помимо концентрации, юный химик мог бы проверить? Укажите не менее двух факторов.
- Приведите уравнения реакций 3–10, подтвердите расчетом.
Уравнения реакций:
- \(\ce{2Al + 6HCl -> 2AlCl3 + 3H2 ^}\);
\(\ce{2Al + 2NaOH + 6H2O -> 2Na[Al(OH)4] + 3H2 ^}\).
(принимаются реакции с образованием алюминатов
\(\ce{Na[Al(H2O)2(OH)4]}\), \(\ce{Na3[Al(OH)6]}\)).
- Для обеих реакций справедливо следующее соотношение: \(\dfrac{n(\ce{H2})}{n(\ce{Al})} = \dfrac{3}{2}\). Тогда \[n(\ce{Al}) = \frac{m(\ce{Al})}{M(\ce{Al})} = \frac{1{,}00}{27} \approx 0{,}0370 \text{ моль},\] \[n(\ce{H2}) = \frac{3}{2} \cdot n(\ce{Al}) = \frac{3}{2} \cdot 0{,}037 \approx 0{,}0556 \text{ моль},\] \[V(\ce{H2}) = n(\ce{H2}) \cdot V_m = 0{,}0556 \cdot 22{,}4 \approx 1{,}245 \text{ л}.\] \[n(\ce{HCl}) = 3 \cdot n(\ce{Al}) = 3 \cdot 0{,}0370 = 0{,}111 \text{ моль},\] \[m(\ce{HCl}) = n(\ce{HCl}) \cdot M(\ce{HCl}) = 0{,}111 \cdot 36{,}5 \approx 4{,}05 \text{ г},\] \[m_{\text{р-ра}} = \frac{m(\ce{HCl})}{w(\ce{HCl})} = \frac{4{,}05}{0{,}15} \approx 27{,}0 \text{ г},\] тогда объем \[V_{\text{р-ра}} = \frac{m_{\text{р-ра}}}{\rho} = \frac{27{,}0 \text{ г}}{1{,}07 \text{ г/мл}} \approx 25{,}2 \text{ мл}.\]
- Среди посуды для получения газов наиболее известен аппарат Киппа, состоящий из резервуара для кислоты и реакционного сосуда и позволяющий регулировать подачу реагента (в частности, кислоты). Кроме того, в учебных целях применяется пробирка с газоотводной трубкой. Другие разумные варианты также оцениваются полным баллом.
Для начала определим металл М. Красноватым налетом на алюминии может быть только восстанавливающийся из раствора металл — медь. На это также указывает последующее описание, к примеру, ожидание сине-фиолетовой окраски при добавлении избытка аммиака. Тогда параллельный процесс: \[\ce{2Al + 3Cu^{2+} -> 2Al^{3+} + 3Cu}.\]
Понятно, что восстановителем и главным источником водорода служит активный алюминий, который, вероятно, реагирует с водой, поскольку покрывавшая его оксидная пленка растворилась. Судя по схеме, первая реакция генерирует ионы водорода, которые в ходе обычной кислотно-основой реакции растворяют оксид алюминия: \[\ce{Al2O3 + 6H+ -> 2Al^{3+} + 3H2O}.\]
Ясно, что при взаимодействии с водой образовывать ионы \(\ce{H+}\) из приведенных веществ могут лишь ионы меди в ходе реакции гидролиза: \[\ce{Cu^{2+} + H2O -> CuOH+ + H+}.\]
Генерация водорода: \[\ce{2Al + 6H+ -> 2Al^{3+} + 3H2 ^};\] \[\ce{2Al + 3H2O -> Al2O3 + 3H2 ^} \text{ или } \ce{2Al + 6H2O -> 2Al(OH)3 + 3H2 ^}.\]
Как было выяснено ранее, оранжево-красная взвесь — крупицы металлической меди.
Темно-зеленый раствор — судя по наличию хлорида натрия в высокой концентрации, а также учитывая дальнейшие превращения, можно заключить, что окраска обусловлена присутствием ионов хлоридных комплексов меди: принимается \(\ce{[CuCl4]^{2-}}\), \(\ce{[CuCl4(H2O)2]^{2-}}\), содержащих различные катионы.
- Помимо концентрации на скорость реакции оказывает влияние температура, а поскольку данная реакция является гетерогенной, то и площадь поверхности алюминия (его присутствие в виде гранул, фольги или пудры). Также на скорость процесса влияет наличие перемешивания.
Для расшифровки необходимо рассмотреть наблюдения ЮХ в совокупности. Отсутствие окрашивания при добавлении аммиака, образование желтого, а не синего осадка при добавлении щелочи указывает на то, что медь восстановилась до \(\ce{Cu(I)}\). Единственный возможный восстановитель — металлическая медь, к тому же ее порошкообразный вид ускоряет реакцию. Образование белого осадка при разбавлении раствора возможно, если раствор А содержит комплекс, устойчивый только в концентрированном растворе. На это также указывает растворимость осадка в соляной кислоте — регенерация комплекса. При окислении этого комплекса образуется зеленый раствор хлоридного комплекса \(\ce{Cu(II)}\).
Тогда уравнения реакций:
- 3. \(\ce{[CuCl4]^{2-} + Cu -> 2[CuCl2]^-}\).
- 4. \(\ce{[CuCl2]^- + 3NH3 + H2O -> [Cu(NH3)2](OH) + NH4Cl + Cl^-}\).
5. \(\ce{2[CuCl2]^- + 2NaOH -> Cu2O + 2NaCl + 2Cl^- + H2O}\).
(допускается \(\ce{[CuCl2]^- + NaOH -> CuOH + NaCl + Cl^-}\)).
- 6. \(\ce{[CuCl2]^- -> CuCl v + Cl^-}\).
- 7. \(\ce{2[CuCl2]^- + NaClO + 2H+ + 4Cl^- -> 2[CuCl4]^{2-} + NaCl + H2O}\).
8. Образование красного осадка говорит о протекании диспропорционирования: \[\ce{Cu2O + H2SO_{4(\text{разб})} -> CuSO4 + Cu v + H2O}.\]
(допускается \(\ce{2CuOH + H2SO_{4(\text{разб})} -> CuSO4 + Cu v + 2H2O}\)).
- 9. \(\ce{2CuSO4 + 4KI -> 2CuI v + I2 + 2K2SO4}\).
- 10. \(\ce{I2 + 2Na2S2O3 -> 2NaI + Na2S4O6}\); \[n(\ce{Cu}) = \frac{m(\ce{Cu})}{M(\ce{Cu})} = \frac{0{,}234}{63{,}5} = 3{,}685 \cdot 10^{-3} \text{ моль};\] \[\begin{aligned} n(\ce{Cu^{2+}}) = 2n(\ce{I2}) = n(\ce{Na2S2O3}) = C(\ce{Na2S2O3}) \cdot V(\ce{Na2S2O3}) \cdot \frac{V_{\text{ал}}}{V_{\text{м.\,к.}}}=\\ = 0,10664 \cdot 4,3 \cdot 10^{-3} \cdot \frac{0,2}{0,025} = 3,685 \cdot 10^{-3} \text{ моль}, \end{aligned}\] что подтверждает реакцию 6.
- Уравнения реакций — по 1,5 балла: 3 балла
- Объем водорода — 4 балла, объем кислоты — 4 балла: 8 баллов
- Посуда для получения газов: 2 балла
- 5 уравнений реакций в схеме — по 2 балла (с неверными коэффициентами — по 1 баллу); указание меди и хлоридного комплекса меди (II) — по 1 баллу: 12 баллов
- Два фактора, влияющие на скорость реакции — по 1,5 балла: 3 балла
Уравнения реакций 3–10 — по 1,5 балла (с неверными коэффициентами — по 1 баллу): 12 баллов
ИТОГО: 40 баллов
Термопласты — полимерные материалы, способные обратимо переходить при нагревании в высокоэластичное либо вязкотекучее состояние. Это свойство облегчает их применение в 3D-печати. Термопласты, сохраняющие свои свойства при температурах более 150 °C, называют высокоэффективными (суперконструкционными) пластиками. Одним из них является полиэфирэфиркетон (ПЭЭК).
ПЭЭК обладает высокой прочностью, стойкостью к износу, радиации, нагреву и действию большинства химических реагентов. В некоторых случаях он может заменить алюминий и сталь, что уменьшает вес изделия в несколько раз (!). Благодаря этому ПЭЭК используется в аэрокосмической и нефтегазовой промышленности, машиностроении и ядерной энергетике. ПЭЭК и композиты на его основе биосовместимы и биоинертны, что позволяет изготавливать из них имплантаты — штифты, эндопротезы позвонков, зубные коронки, фрагменты черепа и др.
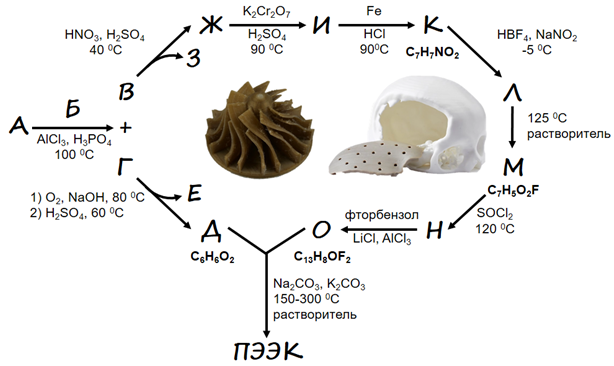
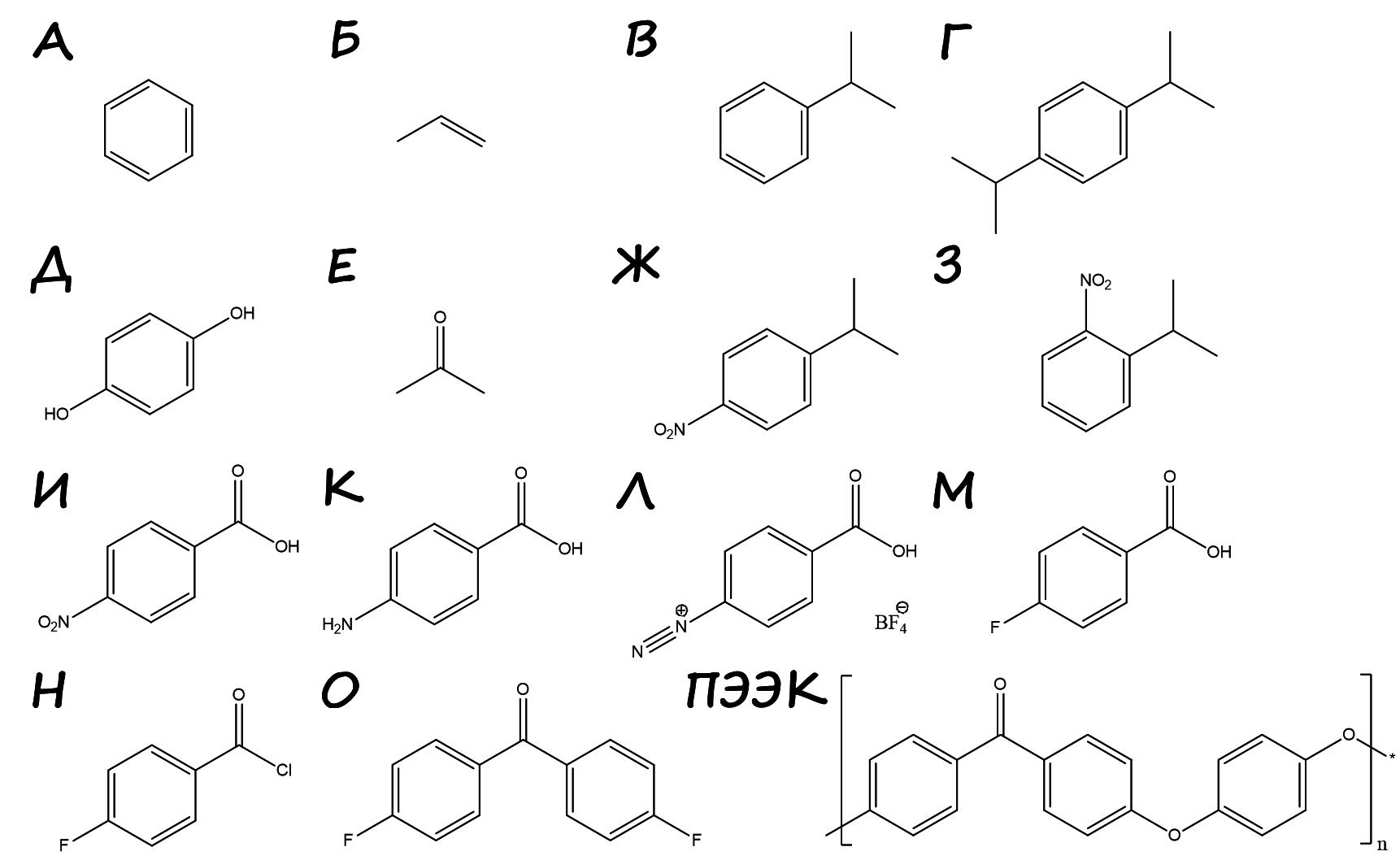
В этой задаче предлагается расшифровать приведенную на рис. 2.2 возможную схему синтеза ПЭЭК взаимодействием Д и О по механизму нуклеофильного замещения.
Известно, что:
- Газовая смесь, полученная при сжигании 10,0 мл токсичной канцерогенной прозрачной жидкости А (плотность 0,881 г/мл), продукта переработки нефти, образует при приведении к нормальным условиям только 6,1 мл прозрачной жидкости и 15,16 л газа. Пропускание этого газа в известковую воду может образовать 67,7 г осадка.
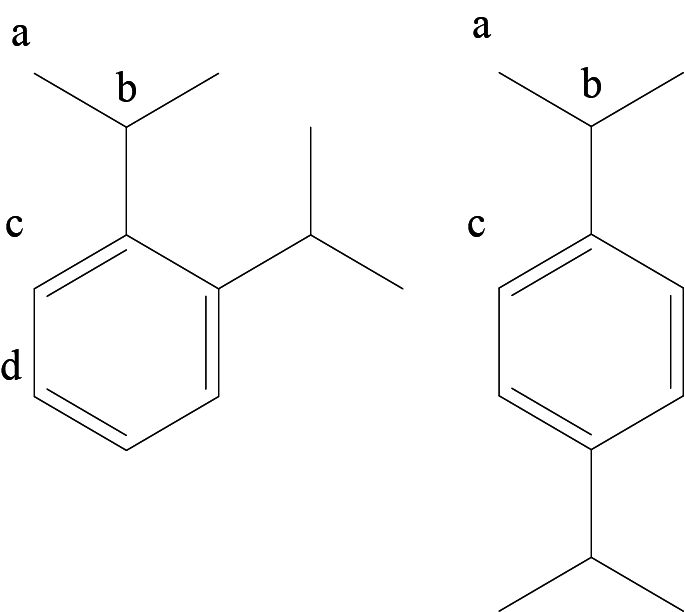
- Крупнотоннажный процесс алкилирования А углеводородом Б, имеющим плотность 1,875 г/л (н. у.), позволяет получить жидкие продукты В (целевой продукт) и Г (один из побочных продуктов). Плотность паров Г больше, чем плотность паров В, в 1,35 раза, при этом Г содержит только 3 типа неэквивалентных атомов водорода.
- Окисление Г воздухом с последующим кислотным гидролизом является промышленным способом получения популярного растворителя Е и бесцветных кристаллов Д, хорошо растворимых в водных растворах щелочей.
- Ж и З — изомеры, причем Ж содержит заместители в пара-ориентации.
- На титрование навески 0,137 г И требуется затратить 8,2 мл раствора гидроксида натрия с концентрацией 0,100 моль/л.
- Расшифруйте приведенную схему, указав структурные формулы веществ А-О, структурную формулу звена ПЭЭК. Подтвердите расчетом, где возможно.
- К какому типу относится процесс получения ПЭЭК — к полимеризации или поликонденсации?
- Вещество К сокращенно называют ПАБК, расшифруйте аббревиатуру.
- В ходе какого процесса переработки нефти получают А?
Прозрачная жидкость, образующаяся при сжигании А, — вода, а газ, приводящий к выпадению осадка с раствором гидроксида кальция (известковой водой), — углекислый газ. Тогда: \[n(\ce{H2O}) = \frac{m}{M} = \frac{6{,}1}{2+16} = 0{,}339 \text{ моль},\] \[n(\ce{CO2}) = \frac{V}{V_m} = \frac{15{,}16}{22{,}4} = 0{,}678 \text{ моль},\] \[n(\ce{CaCO3}) = \frac{m}{M} = \frac{67{,}7}{40+12+16\cdot3} = 0{,}678 \text{ моль}.\]
\[n(\ce{C}) = n(\ce{CO2}) = 0{,}678 \text{ моль},\] \[n(\ce{H}) = 2n(\ce{H2O}) = 0{,}678 \text{ моль},\] \[m(\ce{C}) + m(\ce{H}) = n(\ce{C})M(\ce{C}) + n(\ce{H})M(\ce{H}) = 0{,}678\cdot12 + 0{,}678\cdot1 = 8{,}81 \text{ г},\] что соответствует массе жидкости \(m_{\text{ж}} = \rho V = 0{,}881\cdot10{,}0 = 8{,}81 \text{ г}\) — таким образом, А — углеводород. Поскольку \(n(\ce{C}) = n(\ce{H})\), простейшая формула СН, токсичная канцерогенная жидкость А — это бензол, \(\ce{C6H6}\).
Углеводород Б имеет молярную массу: \[M(\text{Б}) = \rho V_m = 1{,}875\cdot22{,}4 = 42 \text{ г/моль},\] при этом участвует в реакции алкилирования бензола по Фриделю – Крафтсу, следовательно, Б — пропилен, \(\ce{C3H6}\), В и Г — алкилбензолы. Так как: \[\frac{\rho(\text{Г})}{\rho(\text{В})} = \frac{M(\text{Г})}{M(\text{В})} = \frac{M(\ce{C12H18})}{M(\ce{C9H12})} = \frac{162}{120} = 1{,}35,\] В — изопропилбензол (кумол), Г — диизопропилбензол.
При алкилировании изопропилбензола вероятно образование о- и n-изомеров, поскольку алкильная группа является ориентантом I рода. Поскольку о-изомер содержит четыре типа атомов водорода, а n-изомер содержит три типа атомов водорода (неэквивалентные атомы показаны буквами на рис. 2.3), Г — n-изомер (преимущественный продукт из-за стерического фактора).
Рис. 2.3.Окисление диизопропилбензола воздухом приводит к гидроперекиси, кислотный гидролиз которой позволяет получить ацетон Е (популярный растворитель) и гидрохинон Д. Фенольные гидрокси-группы обладают кислотными свойствами, поэтому Д растворяется в водных растворах щелочей.
Взаимодействие кумола с нитрующей смесью является способом получения n-нитрокумола Ж и о-нитрокумола З. n-нитрокумол окисляется дихроматом калия в серной кислоте до n-нитробензойной кислоты И, что подтверждается результатами титрования: \[\ce{RCOOH + NaOH -> RCOONa + H2O};\] \[n(\ce{RCOOH}) = C(\ce{NaOH})\cdot V(\ce{NaOH}) = 0{,}100\cdot8{,}1\cdot10^{-3} = 8{,}1\cdot10^{-4} \text{ моль};\] \[n(\ce{RCOOH}) = n(\ce{NaOH});\] \[M(\ce{RCOOH}) = \frac{m(\ce{RCOOH})}{n(\ce{RCOOH})} = \frac{0{,}137}{8{,}2\cdot10^{-4}} = 167 \text{ г/моль}.\]
Железная стружка в соляной кислоте восстанавливает нитро-группу до амино-группы с образованием n-аминобензойной кислоты К. Ее диазотируют с образованием тетрафторбората диазония Л (принимается указание катиона диазония), которая при разложении образует фторбензойную кислоту М (реакция Шимана). Обработка тионилхлоридом является классическим методом получения хлорангридов (Н), который ацилирует фторбензол по Фриделю – Крафтсу с образованием О. В основных условиях (в присутствии карбонатов натрия и калия) гидрохинон Д депротонируется и вступает в реакцию нуклеофильного замещения с 4,4\(^{\prime}\)-дифторбензофеноном О, образуя ароматических полиэфирэфиркетон (поскольку на одно звено приходится две эфирных и одна кето-группы). Структуры веществ приведены на рис. 2.4.
Рис. 2.4.- Тип процесса — поликонденсация, поскольку образуются побочные низкомолекулярные продукты — фториды металлов.
- Аббревиатуру помогает расшифровать название К: n-аминобензойная кислота.
- Промышленным методом получения ароматических углеводородов из нефти является процесс каталитического риформинга (засчитывается риформинг).
- Формулы веществ А–О, звена ПЭЭК — по 2 балла. Подтверждение расчетом А — 2 балла. Подтверждение расчетом И — 2 балла: 34 балла
- Тип — поликонденсация: 2 балла
- Расшифровка аббревиатуры: 2 балла
Указание риформинга: 2 балла
ИТОГО: 40 баллов
При охлаждении дизельное топливо густеет и превращается в желеобразную массу — дело в том, что содержащиеся в нем линейные молекулы парафинов (алканов) имеют высокие температуры плавления и кристаллизуются. Топливный фильтр не справляется с перекачкой такой массы — двигатель теряет мощность и может «заглохнуть» — поэтому крайне актуальной задачей является производство межсезонного, зимнего и арктического топлива.
Одним из способов производства такого топлива является процесс карбамидной депарафинизации: к нефтепродукту добавляют карбамид, линейные парафины связываются с ним в нерастворимый комплекс, который отфильтровывают.
- Установите формулу карбамида, если известно, что он содержит по массе 46,65% азота. В каких сферах еще применяется это вещество?
Определите формулу алкана, плотность паров которого по кислороду 5,75.
Чистый карбамид имеет тетрагональную кристаллическую структуру (А, на рис. 2.5 изображены три проекции), каждая элементарная ячейка которой представляет собой параллелепипед со сторонами \(a = b = 0{,}566\) нм, \(c = 0{,}471\) нм — в такой плотной решетке отсутствуют полости для размещения молекул другого вещества. При образовании комплекса с парафином кристаллическая структура карбамида меняется с тетрагональной (А) на гексагональную (В): в такой структуре молекулы карбамида образуют спиралевидные каналы, в которые входят молекулы парафина.
Рис. 2.5.- Рассчитайте плотность карбамида в килограммах на кубический метр, имеющего тетрагональную структуру.
- Рассчитайте, сколько молекул мочевины приходится на 1 молекулу тетрадекана \(\ce{C14H30}\) в комплексе, если массовая доля углерода в нем составляет 34,97%.
- Рассчитайте минимальный расход карбамида для депарафинизации дизельной фракции в количестве 1200 кг/ч, если фракция содержит 5% масс. линейных парафинов (примите, что они представлены только тетрадеканом). Если ответить на вопрос п. 4 не удалось, примите количество молекул мочевины на одну молекулу алкана равным 10.
Почему разветвленные алканы не удаляются из топлива в процессе депарафинизации?
Удаление линейных парафинов приводит к снижению цетанового числа топлива и его выхода, поэтому сейчас на замену этому способу приходит каталитическая изодепарафинизации — в ходе этого процесса легкозастывающие линейные парафины превращаются в низкозастывающие разветвленные парафины.
Уфимские ученые использовали для этой цели платину на силикоалюмофосфатах SAPO при температуре 340 °C и давлении 3 МПа. Благодаря полученным результатам, в Институте нефтехимии и катализа Уфимского федерального исследовательского центра РАН (входит в Евразийский научно-образовательный центр) открыли молодежную лабораторию молекулярно-ситовых бифункциональных каталитических систем для получения низкозастывающих дизельных топлив.
Уравнение протекающей реакции изомеризации может быть представлено так, как на рис. 2.6.
Рис. 2.6.- Рассчитайте состав смеси (мольн.%), которая образуется при выдерживании декана над катализатором до установления равновесия, если известно, что константа равновесия изомеризации при 25 °C \(K_p = 10\). Другими реакциями пренебречь.
- Напишите для приведенного алкана уравнение реакции полного сгорания. Рассчитайте теплоты сгорания линейного и изоалкана в килоджоулях на моль, если при полном сжигании 50,0 мл углеводородов выделяется 241,8 кДж и 240,1 кДж соответственно. Плотность углеводородов примите 0,73 г/мл.
- Рассчитайте тепловой эффект реакции изомеризации. Как процесс изодепарафинизации влияет на теплотворную способность топлива?
- Рассчитайте константу равновесия реакции изомеризации при 340 °C. Как на протекание изомеризации влияет нагрев?
- Как на равновесие реакции изомеризации повлияет:
- увеличение давления,
- введение дополнительного количества катализатора,
- отвод декана,
- введение 2-метилнонана?
Справка:
\[\Delta_r G° = \Delta_r H° - T\Delta_r S°,\] \[-RT\ln K_p = \Delta_r G°,\] где \(\Delta_r G°\) — стандартное изменение энергии Гиббса, Дж/моль; \(\Delta_r H°\) — стандартное изменение энтальпии, Дж/моль; \(\Delta_r S°\) — стандартное изменение энтропии, Дж/(моль\(\cdot\)К), \(K_p\) — константа равновесия.
- Карбамид отвечает формуле \(\ce{CH4N2O}\) или \(\ce{(NH2)2CO}\), что легко заметить из кристаллической структуры, приведенной ниже. Формула подтверждается массовой долей азота: \[\omega(\ce{N}) = \frac{2\cdot 14}{60}\cdot 100\% = \frac{28}{60}\cdot 100\% \approx 46{,}67\%.\] Карбамид (мочевина) также используется как азотное удобрение, компонент смол, в производстве пластмасс и лаков.
- Плотность газа по кислороду \(D = \dfrac{M_{\text{алкана}}}{M_{\ce{O2}}}\), то есть: \[M_{\text{алкана}} = D\cdot M_{\ce{O2}} = 5{,}75\cdot 32 = 184 \text{ г/моль}.\] С учетом общей формулы ряда алканов \(\ce{C_nH_{2n+2}}\): \[M_{\text{алкана}} = 12n + 1(2n + 2) = 12n + 2n + 2 = 14n + 2 = 184,\] \[n = 13, \text{ это } \ce{C13H28}.\]
Плотность — это отношение массы ячейки к ее объему: \(\rho = \dfrac{m_{\text{яч}}}{V_{\text{яч}}}\). \[V_{\text{яч}} = a\cdot b\cdot c = a^2\cdot c \text{ (так как } a = b);\] \[V_{\text{яч}} = (0{,}566\cdot 10^{-9})^2\cdot 0{,}471\cdot 10^{-9} = 0{,}151\cdot 10^{-27} \text{ м}^3 \approx 1{,}51\cdot 10^{-28} \text{ м}^3.\]
Из рисунка видно, что каждая молекула принадлежит 2 элементарным ячейкам, таким образом, в ячейке содержится 2 молекулы карбамида. Масса одной молекулы: \[m_{\text{мол}} = \frac{M}{N_A} = \frac{0{,}060}{6{,}022\cdot 10^{23}} \approx 9{,}96\cdot 10^{-26} \text{ кг}.\] Тогда масса ячейки: \[m_{\text{яч}} = 2\cdot m_{\text{мол}} = 2\cdot 9{,}96\cdot 10^{-26} \approx 1{,}99\cdot 10^{-25} \text{ кг}.\] \[\rho = \frac{m_{\text{яч}}}{V_{\text{яч}}} = \frac{1{,}99\cdot 10^{-25}}{1{,}51\cdot 10^{-28}} \approx 1318 \text{ кг/м}^3.\]
- Обозначим число молекул мочевины на 1 молекулу тетрадекана в комплексе \(n\). Тогда: \[M_{\ce{(NH2)2CO}} = 12 + 4 + 28 + 16 = 60 \text{ г/моль},\] \[M_{\ce{C14H30}} = 14\cdot 12 + 30 = 198 \text{ г/моль},\] массовая доля углерода составит: \[\omega(\ce{C}) = \frac{m_{\ce{C}}}{n\cdot M_{\ce{(NH2)2CO}} + M_{\ce{C14H30}}} = \frac{n\cdot 12 + 168}{n\cdot 60 + 198} = 0{,}3497,\] откуда \(n = 11\), то есть комплекс имеет состав \(\ce{C14H30.11(NH2)2CO}\).
- Расход удаляемого линейного парафина составляет: \[m_{\ce{C14H30}} = 1200 \text{ кг/ч}\cdot 0{,}05 = 60 \text{ кг/ч},\] что отвечает: \[n_{\ce{C14H30}} = \frac{m_{\ce{C14H30}}}{14\cdot 12 + 30\cdot 1} = \frac{60 \text{ кг/ч}}{0{,}198 \text{ кг/моль}} \approx 303{,}03 \text{ моль/ч}.\] Тогда: \[n_{\ce{(NH2)2CO}} = 303{,}03 \cdot 11 = 3333{,33} \text{ моль/ч},\] \[\begin{aligned} m_{\text{карбамида}} = n_{\ce{(NH2)2CO}}(12 + 16 + 2\cdot (14 + 2\cdot 1)) = \\=3333,33 \cdot 0,060 = 200 \text{ кг/ч}. \end{aligned}\]
- Разветвленные алканы не образуют комплекс с мочевиной в рассматриваемых условиях, поскольку не помещаются в спиралевидном канале гексагональной структуры карбамида.
Обозначим: н-декан — A, изо-декан — B. Тогда: \[\ce{A <=> B}, \quad K_p = \frac{P_B}{P_A} = 10.\]
Пусть в начальный момент есть только A, его количество 1 моль. В равновесии прореагировало \(x\) моль A, образовав \(x\) моль B. Тогда в равновесии: \[n_A = 1 - x \text{ моль}, \quad n_B = x \text{ моль}.\] Общее количество вещества: \[n_{A+B} = 1 - x + x = 1 \text{ моль}.\]
Парциальные давления (при общем давлении \(P\)): \[P_A = \chi_A P, \quad P_B = \chi_B P,\] где \(\chi_A\), \(\chi_B\) — мольные доли компонентов. Тогда: \[K_p = \frac{P_B}{P_A} = \frac{\chi_B P}{\chi_A P} = \frac{n_B/n_{A+B}}{n_A/n_{A+B}} = \frac{n_B}{n_A} = \frac{x}{1 - x} = 10,\] откуда \(x = 0{,}909\), т. е. \[\chi_A = 1 - x = 9{,}1\%, \quad \chi_B = x = 90{,}9\%.\]
Уравнение реакции: \[\ce{2C10H22 + 31O2 -> 20CO2 + 22H2O}.\]
Масса углеводородов: \[m = \rho\cdot V = 0{,}73 \cdot 50{,}0 = 36{,}5 \text{ г},\] что отвечает: \[n_{\ce{C10H22}} = \frac{m_{\ce{C10H22}}}{M_{\ce{C10H22}}} = \frac{36{,}5}{10\cdot 12 + 22\cdot 1} \approx 0{,}257 \text{ моль}.\]
Таким образом, теплоты сгорания: \[\Delta Q_{\text{сгор.Дек}} = \frac{Q_{\text{дек}}}{n} = \frac{241{,}8}{0{,}257} \approx 941 \text{ кДж/моль},\] \[\Delta Q_{\text{сгор.Изо}} = \frac{Q_{\text{изо}}}{n} = \frac{240{,}1}{0{,}257} \approx 934 \text{ кДж/моль}.\]
К описанной реакции можно применить термохимический цикл, в соответствии с законом Гесса, согласно которому тепловой эффект реакции в изобарных условиях не зависит от пути ее протекания, рис. 2.7.
Рис. 2.7.Отсюда: \[\Delta Q_{\text{изом.}} = \Delta Q_{\text{сгор.Дек}} - \Delta Q_{\text{сгор.Изо}} = 941 - 934 = 7 \text{ кДж/моль}.\]
Видно, что теплота сгорания изоалкана ниже — следовательно, процесс изодепарафинизации снижает теплотворную способность топлива, при этом понижая его температуру застывания.
Запишем выражения энергии Гиббса для констант равновесия при двух температурах: \[\Delta_r G_{T_1}° = -RT_1 \ln K_{T_1} = \Delta_r H° - T_1 \Delta_r S°,\] то есть: \[\ln K_{T_1} = -\frac{\Delta_r H°}{RT_1} + \frac{\Delta_r S°}{R},\] следовательно: \[\ln K_{T_2} = -\frac{\Delta_r H°}{RT_2} + \frac{\Delta_r S°}{R},\] \[\ln K_{T_2} - \ln K_{T_1} = \ln \frac{K_2}{K_1} = -\frac{\Delta_r H°}{R}\left(\frac{1}{T_2} - \frac{1}{T_1}\right).\]
\(\Delta_r H° = -7000\) Дж/моль, тогда: \[\ln \frac{K_2}{10} = -\frac{-7000}{8{,}314}\left(\frac{1}{340+273} - \frac{1}{25+273}\right),\] откуда: \[\frac{K_2}{10} = e^{-1{,}452} \approx 0{,}234, \quad K_2 = 2{,}34.\]
Результат может показаться странным — константа равновесия при реальных условиях проведения процесса ниже, чем при стандартной температуре 25 °C, то есть нагревание смещает равновесие реакции в направлении обратной реакции. Однако на практике такая температура необходима для достижения требуемой скорости протекания процесса (кинетический фактор).
В соответствии с принципом Ле Шателье – Брауна:
- а) увеличение давления не повлияет на равновесие в реакции, поскольку количества газообразных реагентов и продуктов реакции равны, т. е. давление не влияет на произведение реакции;
- б) катализатор не смещает равновесие, но уменьшит время его достижения;
- в, г) в случае снижения концентрации реагентов и увеличения концентрации продуктов равновесие будет смещаться в сторону обратной реакции.
- Формула — 1 балл, применение (достаточно 1 варианта) — 1 балл: 2 балла
- Расчет алкана: 1 балл
- Расчет плотности: 2 балла
- Расчет состава комплекса: 2 балла
- Расчет расхода мочевины: 2 балла
- Указание на размер спиралевидного канала: 1 балл
- Расчет долей компонентов равновесной смеси — по 1,5 балла: 3 балла
- Уравнение реакции — 1 балл (неверные коэффициенты — 0,5 балла), расчет теплот сгорания — по 2 балла: 5 баллов
- Расчет теплоты реакции изомеризации — 2 балла; указание на понижение теплотворной способности топлива — 1 балл: 3 балла
- Расчет константы равновесия: 2 балла
Указание на смещение равновесия — по 0,5 балла: 2 балла
ИТОГО: 25 баллов
Химическому турнирному движению посвящается
Юный химик Тагир участвовал в химическом турнире, и команда поручила ему интересную экспериментальную задачу:
«Одним из методов получения водорода является реакция алюминия с водным раствором сульфата металла М и хлорида натрия. Определите экспериментально, как зависит скорость выделения водорода от концентрации солей. Какие еще факторы оказывают влияние на скорость выделения водорода в данной системе? Объясните наблюдаемые эффекты, приведите схему химических реакций. Растворы каких еще солей могут реагировать с алюминием с быстрым выделением водорода и почему?»

Тагир привел следующую схему протекающих реакций:
Снятие оксидной пленки с алюминия: \[\ldots + \ce{H2O -> }\ldots + \ce{H+};\] \[\ldots + \ldots \ce{ -> }\ldots + \ce{H2O}.\]
Генерация водорода: \[\ldots + \ce{H2O -> }\ldots + \ldots;\] \[\ldots + \ce{H+ -> }\ldots + \ldots\]
Параллельный процесс: \[\ldots + \ldots \ce{ -> } \ldots + \ce{Al^{3+}}.\]

При полном растворении алюминия остается оранжево-коричневая взвесь и темно-зеленый раствор (В). Спустя два дня, безвылазно проведенных в лаборатории, ЮХ закончил исследования.
Как и все юные химики, Тагир не помыл за собой посуду, а когда случайно заглянул в лабораторию через неделю, то с удивлением заметил, что в оставшейся после реакции колбе раствор (р-р А) обесцветился (1). Балуясь, ЮХ прилил к пробе А избыток раствора аммиака, ожидая появления сине-фиолетовой окраски, однако раствор остался бесцветным (2). Тогда к другой пробе он по каплям добавил раствор гидроксида натрия, наблюдая приведший его в недоумение желтый осадок вещества Б (изображено на рис. 2.11) (3). Зато Тагир сразу догадался обо всем, когда заметил выделение белой мути при добавлении к пробе А избытка воды (4). При этом в соляной кислоте белая муть растворялась, снова образуя прозрачный раствор (5). При добавлении к нему гипохлорита натрия раствор становится темно-зеленым, как раствор В (6). Желая проверить свою догадку, ЮХ быстро отфильтровал осадок Б и добавил к нему разбавленной серной кислоты при нагревании, удовлетворенно наблюдая образование небольшого количества красного осадка (6), масса которого после тщательной просушки составила 0,234 г. Раствор, образовавшийся при реакции Б с кислотой, был разбавлен в мерной колбе объемом 200 мл, а к аликвоте (25 мл) полученного раствора ЮХ добавил 5 мл 1 М иодида калия (7), после чего оттитровал 0,10664 М раствором тиосульфата натрия (8). Средний объем затраченного титранта составил 4,3 мл.

- Заполните пропуски в схеме. Какими веществами обусловлены визуальные эффекты после завершения реакции?
- Предположите, влияние каких факторов на скорость выделения водорода, помимо концентрации, юный химик мог бы проверить? Укажите не менее двух факторов.
- Приведите уравнения реакций 1–8, подтвердите расчетом.
- В качестве соли, которая могла бы заменить сульфат М, ЮХ предложил ортофосфат калия. Напишите ионные уравнения реакций, отвечающих за снятие оксидной пленки и генерацию водорода в этом случае.
- Во время проведения процесса Тагир с удивлением заметил, что даже когда поверхность алюминия полностью скрылась за слоем коричневого продукта, скорость выделения водорода не уменьшилась, причем пузырьки образовывались прямо на оранжево-коричневом налете. Объясните наблюдаемый эффект.
Для начала определим металл М. Красноватым налетом на алюминии может быть только восстанавливающийся из раствора металл — медь. На это также указывают последующее описание, к примеру, ожидание сине-фиолетовой окраски при добавлении избытка аммиака. Тогда параллельный процесс: \[\ce{2Al + 3Cu^{2+} -> 2Al^{3+} + 3Cu}.\]
Понятно, что восстановителем и главным источником водорода служит активный алюминий, который, вероятно, реагирует с водой, поскольку покрывавшая его оксидная пленка растворилась. Судя по схеме, первая реакция генерирует ионы водорода, которые в ходе обычной кислотно-основой реакции растворяют оксид алюминия: \[\ce{Al2O3 + 6H+ -> 2Al^{3+} + 3H2O}.\]
Ясно, что при взаимодействии с водой образовывать ионы \(\ce{H+}\) из приведенных веществ могут лишь ионы меди в ходе реакции гидролиза: \[\ce{Cu^{2+} + H2O -> CuOH+ + H+}.\]
Генерация водорода: \[\ce{2Al + 6H+ -> 2Al^{3+} + 3H2 ^};\] \[\ce{2Al + 3H2O -> Al2O3 + 3H2 ^} \text{ или } \ce{2Al + 6H2O -> 2Al(OH)3 + 3H2 ^}.\]
Как было выяснено ранее, оранжево-красная взвесь — крупицы металлической меди.
Темно-зеленый раствор — судя по наличию хлорида натрия в высокой концентрации, а также учитывая дальнейшие превращения, можно заключить, что окраска обусловлена присутствием ионов хлоридных комплексов меди: принимается \(\ce{[CuCl4]^{2-}}\), \(\ce{[CuCl4(H2O)2]^{2-}}\), содержащих различные катионы.
- Помимо концентрации на скорость реакции оказывает влияние температура, а поскольку данная реакция является гетерогенной, то и площадь поверхности алюминия (его присутствие в виде гранул, фольги или пудры). Также на скорость процесса влияет наличие перемешивания.
Для расшифровки необходимо рассмотреть наблюдения ЮХ в совокупности. Отсутствие окрашивания при добавлении аммиака, образование желтого, а не синего осадка при добавлении щелочи указывает на то, что медь восстановилась до \(\ce{Cu(I)}\). Единственный возможный восстановитель — металлическая медь, к тому же ее порошообразный вид ускоряет реакцию. Образование белого осадка при разбавлении раствора возможно, если раствор А содержит комплекс, устойчивый только в концентрированном растворе. На это также указывает растворимость осадка в соляной кислоте — регенерация комплекса. При окислении этого комплекса образуется зеленый раствор хлоридного комплекса \(\ce{Cu(II)}\).
Тогда уравнения реакций:
- \(\ce{[CuCl4]^{2-} + Cu -> 2[CuCl2]^-}.\)
- \(\ce{[CuCl2]^- + 3NH3 + H2O -> [Cu(NH3)2](OH) + NH4Cl + Cl^-}.\)
\(\ce{2[CuCl2]^- + 2NaOH -> Cu2O + 2NaCl + 2Cl^- + H2O}.\)
(допускается \(\ce{[CuCl2]^- + NaOH -> CuOH + NaCl + Cl^-}\)).
- \(\ce{[CuCl2]^- -> CuCl v + Cl^-}.\)
- \(\ce{2[CuCl2]^- + NaClO + 2H+ + 4Cl^- -> 2[CuCl4]^{2-} + NaCl + H2O}.\)
- Образование красного осадка говорит о протекании диспропорционирования: \[\ce{Cu2O + H2SO4 (\text{разб}) -> CuSO4 + Cu v + H2O}.\] (допускается \(\ce{2CuOH + H2SO4 (\text{разб}) -> CuSO4 + Cu v + 2H2O}\)).
- \(\ce{2CuSO4 + 4KI -> 2CuI v + I2 + 2K2SO4}.\)
- \(\ce{I2 + 2Na2S2O3 -> 2NaI + Na2S4O6}.\)
\[\begin{gather} n(\ce{Cu}) = \frac{m(\ce{Cu})}{M(\ce{Cu})} = \frac{0,234}{63,5} = 3,685\cdot 10^{-3} \text{ моль},\\ n(\ce{Cu^{2+}}) = 2n(\ce{I2}) = n(\ce{Na2S2O3}) = C(\ce{Na2S2O3})\cdot V(\ce{Na2S2O3})\cdot \frac{V_{\text{ал}}}{V_{\text{м.\,к.}}}=\\ = 0,10664\cdot 4,3\cdot 10^{-3}\cdot \frac{0,2}{0,025} = 3,685\cdot 10^{-3} \text{ моль}, \end{gather}\] что подтверждает реакцию 6.
В данном случае разрушение пленки происходит за счет гидроксид-ионов, которые образуются при гидролизе: \[\ce{PO4^{3-} + H2O -> HPO4^{2-} + OH^-}\] (достаточно уравнения I ступени гидролиза).
Растворение оксидной пленки: \[\ce{Al2O3 + 2OH^- + 7H2O -> 2[Al(OH)4(H2O)2]^-};\] \[\ce{Al2O3 + 2OH^- + 3H2O -> 2[Al(OH)4]^-};\] \[\ce{Al2O3 + 6OH^- + 3H2O -> 2[Al(OH)6]^{3-}}\] (принимается любое из уравнений).
Генерация водорода (частично): \[\ce{2Al + 2OH^- + 10H2O -> 2[Al(OH)4(H2O)2]^- + 3H2 ^};\] \[\ce{2Al + 2OH^- + 6H2O -> 2[Al(OH)4]^- + 3H2 ^};\] \[\ce{2Al + 6OH^- + 6H2O -> 2[Al(OH)6]^{3-} + 3H2 ^}\] (принимается любое из уравнений).
Стоит отметить, что в некоторых источниках упоминается растворение алюминия в растворе ортофосфата калия при кипячении, однако практически данное утверждение неоднозначно и предложение ЮХ сомнительно.
- В описанном случае происходит образование гальванической пары, когда более активный алюминий окисляется, а выделяющиеся при этом электроны переходят на медь, где и происходит процесс восстановления с выделением водорода. Образование гальванической пары не только не замедляет процесс, но даже ускоряет его. Поэтому в данном методе получения водорода обычно используют именно соли малоактивных металлов, образующих с алюминием гальваническую пару, а не просто соли, снимающие оксидную пленку.
- 5 уравнений реакций в схеме — по 2 балла (с неверными коэффициентами — по 1 баллу); указание меди и хлоридного комплекса меди (II) — по 1 баллу: 12 баллов
- 2 фактора, влияющие на скорость реакции — по 1 баллу: 2 балла
- Уравнения реакций 1–8 — по 2 балла (с неверными коэффициентами — по 1 баллу): 16 баллов
- 3 уравнения реакции, объясняющие действие ортофосфата калия — по 1 баллу: 3 балла
Указание на образование гальванической пары: 2 балла
ИТОГО: 35 баллов