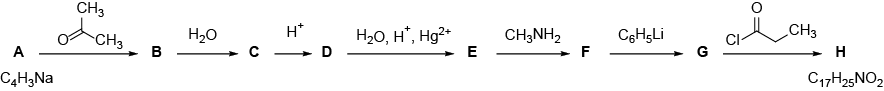Предметный тур. Химия. 3 этап
Смесь порошка А с металлическим блеском и черного порошка Б способна сгорать ослепительным пламенем даже без доступа воздуха. При обработке избытком раствора щелочи 10 г смеси выделяется 2,95 л газа (н. у.), при обработке той же массы смеси соляной кислотой выделяется тот же газ в том же количестве. При прокаливании 10 г смеси в токе угарного газа ее масса уменьшается на 2,1 г.
- Определите А и Б, в каком соотношении (по массе) они находятся в смеси? Расчеты проводите с точностью до десятых. Молярные массы рассчитывайте с точностью до целых. В ответе приведите массовое содержание приведите в процентах с точностью до целых.
Как называется смесь, откуда происходит ее название?
Вместо черного порошка Б можно использовать бурый В, состоящий из тех же элементов.
- В каком соотношении (по массе) тогда надо взять А и В, чтобы реакция горения прошла полностью? Расчеты проводите с точностью до десятых. Молярные массы рассчитывайте с точностью до целых. В ответе приведите массовое содержание в процентах с точностью до целых.
- Напишите уравнения всех реакций.
Из условия задачи можно предположить, что А — алюминий, а Б — \(\ce{Fe3O4}\). Подтвердим данные расчетами.
С выделением газа из двух компонентов смеси с щелочью и кислотой взаимодействует только алюминий: \[\begin{aligned} \ce{2Al + 2NaOH + 6H2O &= 2Na[Al(OH)4] + 3H2}; \\ \ce{2Al + 6HCl &= 2AlCl3 + 3H2}. \end{aligned}\] Рассчитаем массу алюминия: \[m_{\ce{Al}} = n_{\ce{Al}} \cdot M_{\ce{Al}} = \frac{2 \cdot n_{\ce{H2}} \cdot M_{\ce{Al}}}{3} = \frac{2 \cdot V_{\ce{H2}} \cdot M_{\ce{Al}}}{3 \cdot V_m} = \frac{2 \cdot 2{,}95 \cdot 27}{3 \cdot 22{,}4} = 2{,}4~\text{г}.\] Тогда масса Б — 7,6 г. Проверим, совпадет ли с заданным показатель потери массы:
\[\begin{aligned} \ce{Fe3O4 + 4CO = 3Fe + 4CO2}; \\ \Delta m = m_{\ce{Fe3O4}} - m_{\ce{Fe}} = m_{\ce{Fe3O4}} - \frac{3 \cdot m_{\ce{Fe3O4}} \cdot M_{\ce{Fe}}}{M_{\ce{Fe3O4}}}= \\ = 7,6 - \frac{3 \cdot 7,6 \cdot 56}{232} = 2,1~\text{г}. \end{aligned}\]
Осталось рассчитать массовое содержание: \[\begin{aligned} \omega_A &= \frac{m_A}{m} \cdot 100\% = \frac{2,4}{10} \cdot 100\% = 24\%, \\ \omega_B &= \frac{m_B}{m} \cdot 100\% = \frac{7,6}{10} \cdot 100\% = 76\%. \end{aligned}\]
- Термитная смесь, происходит от греческого слова «термос» — тепло.
- Вещество В — \(\ce{Fe2O3}\): \[\begin{aligned} \ce{Fe2O3 + 2Al &= Al2O3 + 2Fe}. \end{aligned}\] Исходя из уравнения реакции, для полного превращения на 1 моль вещества В необходимо 2 моль алюминия, тогда: \[\begin{aligned} m_{\ce{Fe2O3}} &= n \cdot M = 1 \cdot 160 = 160~\text{г}; \\ m_{\ce{Al}} &= n \cdot M = 2 \cdot 27 = 54~\text{г}. \end{aligned}\] Масса всей смеси составляет 214 г, а содержание А и В — 25% и 75% соответственно.
- \[\begin{aligned} \ce{8Al + 3Fe3O4 &= 9Fe + 4Al2O3}; \\ \ce{2Al + 2NaOH + 6H2O &= 2Na[Al(OH)4] + 3H2}; \\ \ce{2Al + 6HCl &= 2AlCl3 + 3H2}; \\ \ce{Fe3O4 + 8HCl &= FeCl2 + 2FeCl3 + 4H2O}; \\ \ce{Fe3O4 + 4CO &= 3Fe + 4CO2}; \\ \ce{Fe2O3 + 2Al &= Al2O3 + 2Fe}. \end{aligned}\]
- 4 балла за ответ, только с расчетами.
- 2 балла.
- 4 балла.
- 12 баллов за пункт (по 2 балла за каждую реакцию).
Приведена общая формула минерала — \(\ce{M5(X)3Y}\), который является прекурсором для получения белого фосфора, если его ввести в реакцию восстановления углеродом в присутствии оксида кремния. Известно, что при растворении минерала в серной кислоте (в присутствии воды) образуется кислота 1, гипс и газ, который также отдельно собирают. Этот газ является ключевым компонентом, используемым в получении кислоты 2, которую недопустимо хранить или перевозить в стеклянной таре.
- Установите химическую формулу минерала и приведите его систематическое и тривиальное название.
- Приведите уравнения всех перечисленных реакций.
- Почему кислоту 2 нельзя хранить или перевозить в стеклянной таре? Приведите уравнение реакции.
- Сравните силу кислоты 2 с аналогичными кислотами внутри одной группы Периодической системы химических элементов. Какая из этих кислот наиболее сильная и почему?
- Предложите химический способ получения исследуемого минерала, исходя из водных растворов солей металла М.
- Какое количество миллилитров 4 М водного раствора гидроксида натрия потребуется для полной нейтрализации кислоты 1, полученной в ходе растворения 5 г минерала в серной кислоте? Расчеты проводите с точностью до пятого знака после запятой.
Из условия задачи известно, что при растворении минерала в серной кислоте образуется гипс — \(\ce{CaSO4* 2H2O}\). Так, получается, что M — Ca. Еще одним продуктом растворения является газ, который является компонентом кислоты 2, которую нельзя хранить в стеклянной таре. Такой кислотой является плавиковая кислота, а значит, газ — \(\ce{HF}\).
Также известно, что минерал — прекурсор в получении фосфора, значит, еще одним его компонентом является группа, в состав которой входит фосфор. Предположим, что кислота, образуемая при растворении минерала в серной кислоте, — \(\ce{H3PO4}\).
Таким образом, предполагаемая формула минерала — \(\ce{Ca5(PO4)3F}\). Подтвердим эту теорию. Общий заряд молекулы должен быть равен 0: \[Z = 5 \cdot (2+) + 3 \cdot (3-) + 1 \cdot (-1) = 0.\] При замене местами анионов равенства не получится. Тогда полученный минерал называется фосфат-фторид кальция или фтороапатит (фторапатит).
- Составим уравнения: \[\begin{aligned} \ce{Ca5(PO4)3F + 5H2SO4 + 10H2O} &= \ce{3H3PO4 + 5CaSO4* 2H2O + HF}; \\ \ce{4Ca5(PO4)3F + 18SiO2 + 30C} &= \ce{3P4 + 2CaF2 + 18CaSiO3 + 30CO}. \end{aligned}\] Или: \[\begin{aligned} \ce{4Ca5(PO4)3F + 21SiO2 + 30C} &= \ce{6P2 + SiF4 + 20CaSiO3 + 30CO}; \\ \ce{2P2 &= P4}. \end{aligned}\]
- Кислота 2 — это плавиковая кислота, способная разъедать стекло. \[\begin{aligned} \ce{4HF + SiO2} &= \ce{SiF4 + 2H2O}. \end{aligned}\]
- Сравнение будем проводить в ряду галогенов: \[\ce{HF} < \ce{HCl} < \ce{HBr} < \ce{HI}.\] Сила кислоты зависит от степени ее диссоциации и от силы притяжения между атомами водорода и галогена. По мере увеличения радиуса атома сила притяжения уменьшается, и, как следствие, повышается степень диссоциации кислоты.
- Минерал можно получить постадийно — сначала происходит образование ортофосфата кальция, а затем — введение фторида: \[\begin{aligned} \ce{3Ca^2+ + 2PO4^3-} &= \ce{Ca3(PO4)2}; \\ \ce{3Ca3(PO4)2 + CaF2} &= \ce{2Ca5(PO4)3F}. \end{aligned}\]
- Составим уравнение реакции: \[\begin{aligned} \ce{Ca5(PO4)3F + 5H2SO4 + 10H2O }&= \ce{3H3PO4 + 5CaSO4* 2H2O + HF}; \\ \ce{H3PO4 + 3NaOH} &= \ce{Na3PO4 + 3H2O}. \end{aligned}\] Рассчитаем количество вещества минерала: \[n_{\text{мин}} = \frac{m}{M} = \frac{5}{504{,}3} = 0{,}00991~\text{моль}.\] Количество вещества кислоты составит 0,02973 моль, а количество вещества гидроксида натрия — 0,08919 моль. Тогда: \[V = \frac{n}{C} = \frac{0{,}08919}{4} = 0{,}02230~\text{л} = 22{,}3~\text{мл}.\]
- 3 балла.
- 5 баллов (по 2,5 балла за уравнение).
- 2 балла.
- 5 баллов.
- 5 баллов.
- 5 баллов.
На Международной космической станции перхлорат лития используется для хранения кислорода. Вещества А и В также способны в ходе своего разложения выделять кислород. Известно, что вещество A может быть получено путем гидролиза гигроскопичного вещества, образующегося в ходе электролиза холодной серной кислоты.
В свою очередь вещество B является известным лабораторным окислителем, который способен давать разные продукты восстановления в зависимости от среды реакции.
Эффективность соединения для хранения кислорода определяется его отношением кислорода к объему (OV), который можно рассчитать как отношение высвобожденного кислорода к объему исходного соединения.
Плотность перхлората составляет 2,42 г/см\(^3\), вещества A — 1,40 г/см\(^3\), а вещества B — 2,70 г/см\(^3\).
- Определите формулы соединений A и B. Для получения вещества A приведите уравнения реакций. Для вещества B приведите возможные продукты его восстановления в зависимости от среды.
- Приведите уравнения разложения всех веществ, упомянутых в условиях задачи, и рассчитайте для них OV (с точностью до целых) при температуре 25 °С и стандартном давлении, а также оцените эффективность их использования. Концентрацию вещества A примите 100%.
Наиболее известные лабораторные способы получения кислорода — это каталитическое разложение перекиси водорода в присутствии оксида марганца (IV) и термическое разложение перманганата калия. (2 балла)
Известно, что один из первых промышленных способов получения перекиси водорода состоит в электролизе серной кислоты и последующем гидролизе продукта. Так, вещество A — \(\ce{H2O2}\). (2 балла)
Приведем уравнения получения: \[\begin{aligned} \ce{2H2SO4 &->[e^-, 0°C] H2S2O8 + H2}; \\ \ce{H2S2O8 + 2H2O &= H2O2 + 2H2SO4}. \end{aligned}\] (4 балла, 2 балла за уравнение)
Перманганат калия активно используется в лабораторном практикуме в роли окислителя, а продукты его восстановления зависят от среды:
- кислая среда — \(\ce{Mn^2+}\);
- основная среда — \(\ce{K2MnO4}\);
- нейтральная среда — \(\ce{MnO2}\).
(2 балла)
Так, вещество B — \(\ce{KMnO4}\). (2 балла)
12 баллов за пункт.
Приведем все уравнения реакций разложения: \[\begin{aligned} \ce{LiClO4 &= LiCl + 2O2}; \\ \ce{2H2O2 &->[MnO2] 2H2O + O2}; \\ \ce{2KMnO4 &= K2MnO4 + MnO2 + O2}. \end{aligned}\] (3 балла, по 1 баллу за уравнение)
Установим объем кислорода, который выделяется в ходе реакции разложения, однако, важно учесть, что наши условия не относятся к н. у. Поэтому нужно привести молярный объем к нашим условиям согласно закону Клайперона: \[V = \frac{V_m \cdot T}{T_{\text{ст}}} = \frac{22{,}4 \cdot 298{,}15}{273{,}15} = 24{,}5~\text{л/моль}.\] Из 1 моль перхлората лития получается 2 моль кислорода. Тогда объем кислорода составит: \[V_{\ce{O2}} = V \cdot n_{\ce{O2}} = 24{,}5 \cdot 2 = 49~\text{л}.\] Масса 1 моль перхлората лития составляет 106,4 г, тогда его объем: \[V_A = \frac{m_A}{\rho} = \frac{106{,}4}{2{,}42} = 43{,}97~\text{см}^3.\] Осталось рассчитать OV: \[OV = \frac{49000}{43{,}97} = 1114.\] (4 балла)
Из 1 моль вещества А получается 0,5 моль кислорода. Тогда объем кислорода составит: \[V_{\ce{O2}} = V \cdot n_{\ce{O2}} = 24{,}5 \cdot 0{,}5 = 12{,}25~\text{л}.\] Масса 1 моль вещества А составляет 34 г, тогда его объем: \[V_A = \frac{m_A}{\rho} = \frac{34}{1{,}40} = 24{,}29~\text{см}^3.\] Осталось рассчитать OV: \[OV = \frac{12250}{24{,}29} = 504.\] (2 балла)
Из 1 моль вещества B получается 0,5 моль кислорода. Тогда объем кислорода составит: \[V_{\ce{O2}} = V \cdot n_{\ce{O2}} = 24{,}5 \cdot 0{,}5 = 12{,}25~\text{л}.\] Масса 1 моль вещества B составляет 158 г, тогда его объем: \[V_A = \frac{m_A}{\rho} = \frac{158}{2{,}70} = 58{,}52~\text{см}^3.\] Осталось рассчитать OV: \[OV = \frac{12250}{58{,}52} = 209.\] (2 балла)
Таким образом, наиболее эффективным является все же перхлорат лития. (2 балла)
13 баллов за пункт.
Химики в своих экспериментах часто используют тяжелую воду (\(\ce{D2O}\)). Большинство реактивов, в том числе тяжелую воду, продают не в единицах объема, а в единицах массы. К сожалению, недобросовестные производители с целью экономии могут в тяжелой воде растворять некоторое количество хлорида натрия, что позволяет увеличить ее массу и при этом использовать меньший объем. В лаборатории, с целью оценки чистоты купленной тяжелой воды, решили провести ее анализ с помощью аргентометрии по методу Мора, который заключается в титровании растворов хлорида натрия нитратом серебра в присутствии 5%-го раствора хромата калия (индикатор). В ходе такого титрования наблюдается выпадение осадка (эта реакция необратимая и происходит раньше, чем взаимодействие титранта с индикатором). Точка эквивалентности фиксируется при появлении темного-красного цвета раствора, что свидетельствует об образовании \(\ce{Ag2CrO4}\).
При оценке чистоты тяжелой воды на первом этапе проводили подготовку к анализу — готовили 0,1 М раствор титранта и стандартизировали его, используя стандартный 1 М титр хлорида натрия, разбавленный в 10 раз. На титрование 20 мл раствора нитрата серебра (в присутствии 0,5 мл индикатора) в среднем понадобилось 24 мл стандартного раствора (по результатам трех экспериментов). Это позволило установить точную концентрацию раствора титранта. Затем проводили титрование тяжелой воды стандартизированным титрантом: отбирали по 20 мл исследуемой тяжелой воды, добавляли 0,5 мл индикатора и проводили процесс титрования. На титрование \(\ce{D2O}\) было израсходовано следующее количество титранта: 14 мл, 15 мл, 16 мл, 17 мл и 18 мл.
- Приведите все уравнения реакций.
- Определите истинную молярную концентрация раствора титранта (с точностью до третьего знака после запятой).
- Рассчитайте массовую долю хлорида натрия в исследуемой тяжелой воде массой 1 кг (ответ приведите в процентах с точностью до десятых). Оцените потери покупателей, если известно, что 1 кг тяжелый воды стоит 370 тыс. руб. Плотность тяжелой воды примите равной 1 г/см\(^3\).
- Какая масса хромата калия в граммах потребовалась для проведения ВСЕХ экспериментов (включая стандартизацию титранта). Плотность раствора примите равной 1 г/см\(^3\).
- Уравнения: \[\begin{aligned} \ce{AgNO3 + NaCl &= AgCl + NaNO3}; \\ \ce{2AgNO3 + K2CrO4 &= Ag2CrO4 + 2KNO3}. \end{aligned}\]
- Из титра был приготовлен раствор хлорида натрия путем его разбавления в 10 раз. Тогда его концентрация составила 0,1 М. Концентрация раствора нитрата серебра составила: \[C_{\text{т}} = \frac{n_{\text{т}}}{V_{\text{т}}} = \frac{n_{\text{ст}}}{V_{\text{т}}} = \frac{C_{\text{ст}} \cdot V_{\text{ст}}}{V_{\text{т}}} = \frac{0{,}1 \cdot 24 \cdot 10^{-3}}{20 \cdot 10^{-3}} = 0{,}120~\text{М}.\]
- Сначала определим среднее значение объема затраченного титранта: \[V_{\text{ср}} = \frac{14 + 15 + 16 + 17 + 18}{5} = 16~\text{мл}.\] Определим теперь количество вещества хлорида натрия в аликвоте: \[n_a = C_{\text{т}} \cdot V_{\text{ср}} = 0{,}120 \cdot 16 \cdot 10^{-3} = 0{,}00192~\text{моль}.\] Определим количество вещества в 1 кг тяжелой воды: \[m = n \cdot M = \frac{n_a \cdot 1000 \cdot M}{16} = \frac{0{,}00192 \cdot 1000 \cdot 58{,}4}{16} = 7{,}008~\text{г}.\] Тогда массовая доля хлорида натрия составляет: \[\omega = \frac{m}{m_{\text{тв}}} \cdot 100\% = \frac{7{,}008}{1000} \cdot 100\% = 0{,}7\%.\] Таким образом, 0,7% от стоимости тяжелой воды составляет хлорид натрия, а потери — 2590 руб.
- Сначала определим, сколько раствора индикатора потребовалось для анализа. Всего было восемь экспериментов по 0,5 мл — 4 мл или 4 г. Из 4 г 5% — это хромат калия. Тогда необходимая масса хромата калия составит 0,2 г.
- 2 балла.
- 5 баллов.
- 10 баллов (по 2 балла за каждое уравнение).
- 8 баллов.
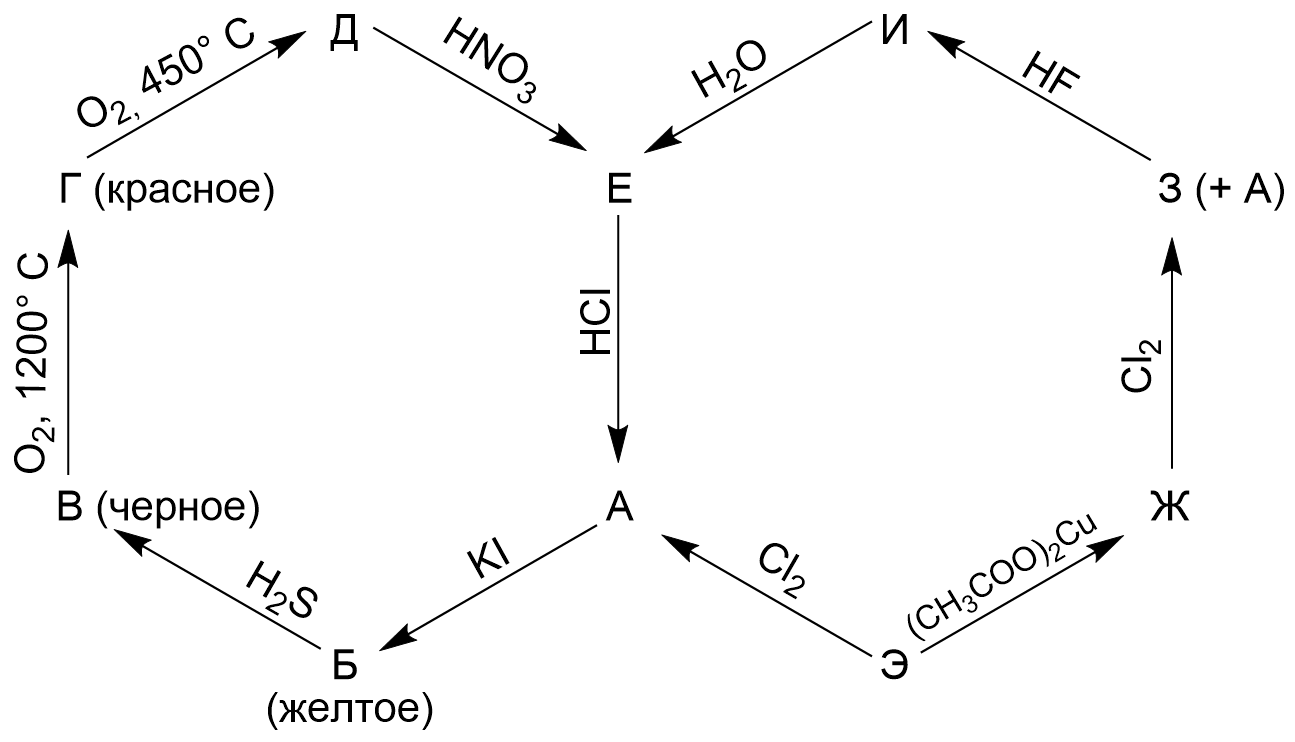
Металл Э известен человечеству с древнейших времен. На схеме (рис. 2.1) зашифрованы превращения содержащих Э веществ.
В таблице 1.1 приведена массовая доля Э в процентах для некоторых соединений:
| Д | Е | Ж | З |
|---|---|---|---|
| 90,70 | 86,67 | 63,80 | 46,85 |
- Определите Э и формулы веществ А – И, напишите уравнения всех реакций.
- У соединений В, Г, Д и Ж есть традиционные названия, приведите их.
- Соединение Ж было известно еще в античности, многие древние римляне потеряли здоровье и даже умерли от отравления им, как это произошло?
- Какое основное применение у металлического Э сегодня? Какой процесс лежит в основе этого применения?
Э — свинец. (1 балл)
Формулы веществ:
- А — \(\ce{PbCl2}\) — хлорид свинца (II).
- Б — \(\ce{PbI2}\) — иодид свинца (II).
- В — \(\ce{PbS}\) — сульфид свинца (II).
- Г — \(\ce{PbO}\) — оксид свинца (II).
- Д — \(\ce{Pb3O4}\) — оксид свинца (II, IV).
- Е — \(\ce{PbO2}\) — оксид свинца (IV).
- Ж — \(\ce{(CH3COO)2Pb}\) — ацетат свинца (II).
- З — \(\ce{(CH3COO)4Pb}\) — ацетат свинца (IV).
- И — \(\ce{PbF4}\) — фторид свинца (IV).
(0,5 балла за каждую формулу, 0,5 балла за название, всего 9 баллов)
Уравнения реакций: \[\begin{aligned} \ce{Pb + Cl2 &= PbCl2}; \\ \ce{PbCl2 + 2KI &= PbI2 + 2KCl}; \\ \ce{PbI2 + H2S &= PbS + 2HI}; \\ \ce{2PbS + 3O2 &= 2PbO + 2SO2}; \\ \ce{6PbO + O2 &= 2Pb3O4}; \\ \ce{Pb3O4 + 4HNO3 &= 2Pb(NO3)2 + 2H2O + PbO2}; \\ \ce{PbO2 + 4HCl &= PbCl2 + Cl2 + 2H2O}; \\ \ce{Pb + (CH3COO)2Cu &= Cu + (CH3COO)2Pb}; \\ \ce{2(CH3COO)2Pb + Cl2 &= (CH3COO)4Pb + PbCl2}; \\ \ce{(CH3COO)4Pb + 4HF &= PbF4 + 4CH3COOH};\\ \ce{PbF4 + 2H2O &= PbO2 + 4HF}. \end{aligned}\] (1 балл за каждое уравнение)
(21 балл за пункт)
Традиционные названия:
- В — галенит;
- Г — глет;
- Д — сурик;
- Ж — свинцовый сахар.
(2 балла, по 0,5 балла за название)
- Ацетат свинца сладкий, им подслащали вино, а все растворимые соли свинца ядовиты. (1 балл)
- Основное применение свинца — свинцово-кислотные аккумуляторы. Принцип работы аккумулятора основан на окислительно-восстановительной реакции между металлическим свинцом и \(\ce{PbO2}\). (1 балл)
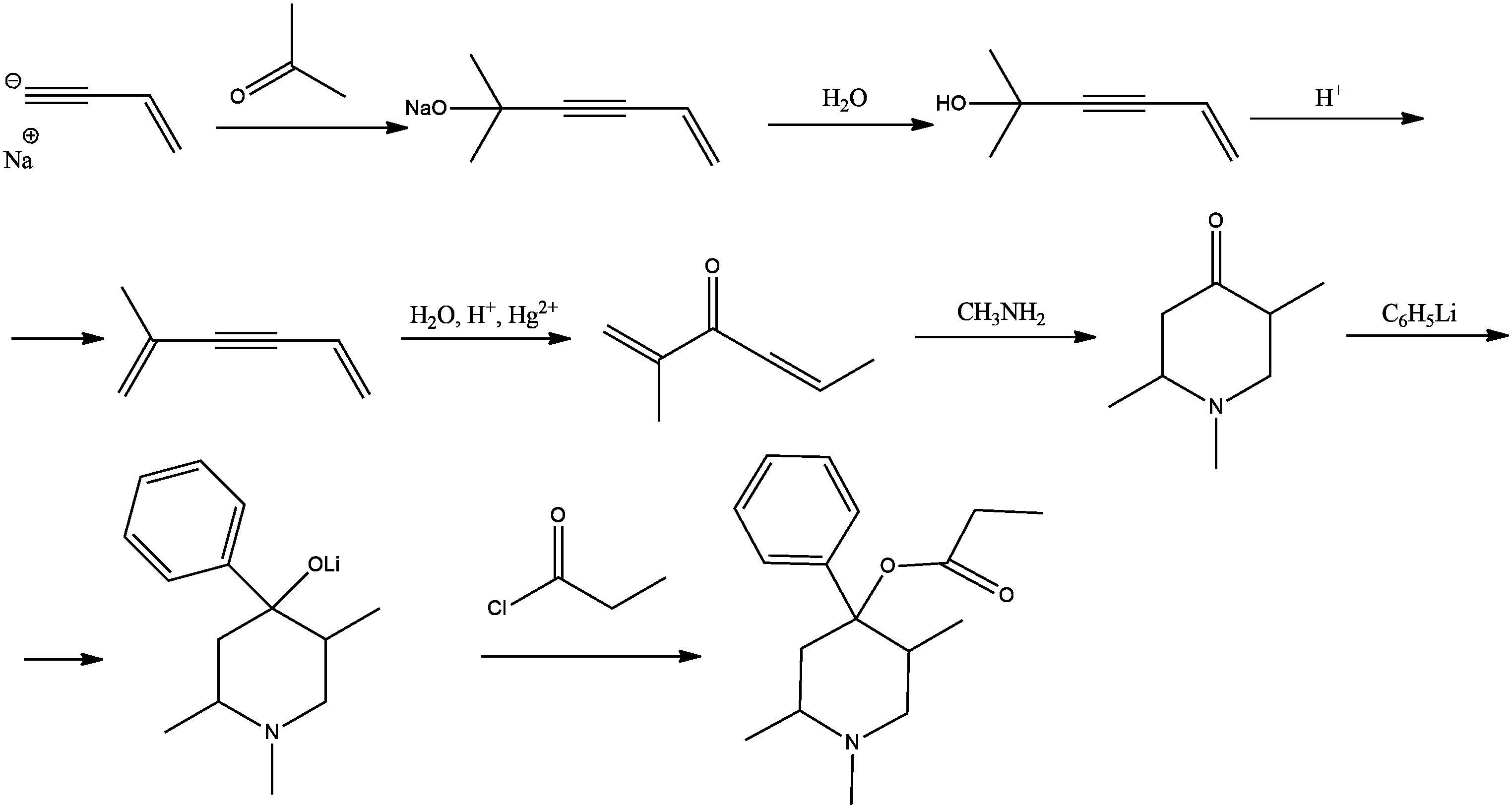
На рис. 2.2 описан синтез вещества Н — широко применяемого для анестезии лекарственного вещества.
- Установите структурные формулы веществ А – Н. Напишите уравнения всех реакций, если известно, что вещество F содержит гетероцикл.
- В молекуле вещества Н есть несколько хиральных центров. Известно, что образование нескольких стереоизомеров нежелательно при получении лекарственных веществ. Сколько существует стереоизомеров у вещества Н? Предположите, почему при производстве оптически активных лекарственных веществ тщательно контролируют оптическую чистоту полученных соединений.
- Известно, что лекарственное вещество Н обладает плохой растворимостью в воде. Опишите, почему это является критическим недостатком для лекарственного вещества. Укажите, каким образом можно добиться высокой растворимости вещества Н.
- Во время операции средняя вводимая доза лекарственного препарата составляет 0,03 мг/кг/час в виде 2%-го раствора. Какую минимальную массу вещества А необходимо взять для синтеза такого количества Н, которого хватит для обеспечения общей анестезии в течение 5 ч человека с массой тела, равной 60 кг? Считайте выход на каждой стадии равным 70%. Примите, что в ходе реакции образуется только один стереоизомер вещества Н.
Вещество Н — промедол (тримеперидин).
Рис. 2.3.Верные структурные формулы каждого вещества — по 1,5 балла, всего — 12 баллов.
Число стереоизомеров = \(2^n\), где \(n=3\). Тогда для соединения Н число стереоизомеров = \(2^3 = 8\).
Стереоизомеры могут обладать разной биологической активностью. Один (или несколько) из них обладают необходимым действием на организм, остальные могут быть либо биологически неактивны, либо токсичны. В первом случае без разделения стереоизомеров общая активность лекарственного препарата будет снижена, во втором случае лекарственный препарат нельзя выпускать и использовать.
Верный ответ на первый вопрос — 2 балла. Краткий ответ на второй вопрос — 2 балла, развернутый — 4 балла. Всего за пункт — 6 баллов.
Низкая растворимость лекарственного вещества в воде обуславливает низкую биодоступность препарата, так как организм человека является водной средой. Это влечет за собой неактивность препарата, низкую всасываемость и плохое распределение по организму.
Высокой растворимости вещества Н можно добиться переводом его в соль — гидрохлорид, гидросульфит и т. д. Наличие ионной связи (ионов, ионной кристаллической решетки) обеспечит хорошую растворимость в воде.
Верный ответ на первый вопрос — 3 балла, верный ответ на второй вопрос — 3 балла. Всего за пункт — 6 баллов.
Суммарный выход по 7 стадиям: \[\eta = (0{,}7)^7 = 0{,}082 = 8{,}2\%.\]
Суммарная необходимая масса Н: \[m = 0{,}03~\text{мг} \cdot 60~\text{кг} \cdot 5~\text{часов} = 9~\text{мг}.\]
Теоретическая масса Н с учетом суммарного выхода всех стадий составляет: \[m_{\text{теор}} = \frac{9}{0{,}082} = 109{,}8~\text{мг}.\]
Количество вещества Н: \[n(\text{Н}) = \frac{109{,}8}{275} = 0{,}4~\text{ммоль}.\]
Соотношение веществ А и Н равно единице, поэтому \[n(\text{A}) = n(\text{Н}) = 0{,}4~\text{моль}.\]
Необходимая масса вещества А составляет: \[m(\text{А}) = 0{,}4 \cdot 74 = 29{,}6~\text{мг}.\]
(6 баллов)
Полиэтиленгликоль (ПЭГ) является важным полимером, который находит свое применение во всех отраслях химии. Его получают путем присоединения окиси этилена к этиленгликолю в присутствии щелочного катализатора.
Важной физико-химической характеристикой ПЭГ является гидроксильное число (мг KOH/г), которое показывает степень оксиалкилирования исходных гликолей, количество гидроксильных групп, а также молекулярную массу полиэфира, что позволяет оценить его реакционную способность.
Под гидроксильным числом понимают количество миллиграммов гидроксида калия, необходимое для нейтрализации карбоновой кислоты, выделяющейся при ацилировании 1 г навески анализируемого вещества соответствующим ангидридом карбоновой кислоты. В частности, используется метод Огга – Портера, который заключается в ацилировании гидроксильных групп уксусным ангидридом в среде пиридина, последующем гидролизе избытка ангидрида до кислоты и ее титровании спиртовым раствором гидроксида калия в присутствии индикатора.
Перед проведением анализа готовят ацилирующую смесь из свежеперегнанных уксусного ангидрида и пиридина в объемном соотношении \(1 : 3\). Для этого в колбу вносят 5 мл уксусного ангидрида и 15 мл пиридина и перемешивают. Затем в другую колбу добавляют навеску 1,00 г исследуемого ПЭГ и 1 мл ацилирующей смеси и нагревают в течение 40 мин, после в колбу добавляют 2 мл воды и нагревают еще 5 мин и охлаждают. В качестве титранта используют 0,1 М раствор гидроксида калия в этаноле, а в качестве индикатора — фенолфталеин, реагирующий на щелочную среду. Для определения гидроксильного числа также оттитровывают холостую пробу без добавления ПЭГ. В ходе анализа на титрование холостой пробы потребовалось 12 мл титранта, а для исследуемого образца 8 мл.
- Приведите уравнение реакции получения ПЭГ.
- Приведите уравнения всех реакций в ходе исследования.
- Определите гидроксильное число исследуемого ПЭГ с точностью до сотых.
- Выведите формулу определения молярной массы исследуемого ПЭГ и выполните расчет с использованием гидроксильного числа. Результаты приведите с точностью до целых.
Справочные данные: \(M (\text{KOH}) = 56{,}1\) г/моль.
- Уравнение реакции получения ПЭГ: \[\ce{HOCH2CH2OH + n(CH2CH2O) ->[kt] HO(CH2CH2O)_{n+1}H}.\] (2 балла)
Уравнения реакций, проведенных в ходе анализа: \[\begin{aligned} \ce{HO(CH2CH2O)_{n+1}H + 2Ac2O &->[Py] AcO(CH2CH2O)_{n+1}Ac + 2CH3COOH}; \\ \ce{Ac2O + H2O &-> 2CH3COOH}; \\ \ce{CH3COOH + KOH &-> CH3COOK + H2O}. \end{aligned}\]
(6 баллов, по 2 балла за уравнение)
Для начала определим объем титранта, который был затрачен на титрование уксусной кислоты, которая была получения в ходе реакции ацилирования: \[V_a = V_{\text{х}} - V = 12 - 8 = 4~\text{мл}.~ (\textit{1 балл})\]
Теперь можно определить количество вещества гидроксида калия, которое также потребовалось для титрования выделившейся в ходе ацилирования кислоты: \[n_{\text{KOH}} =C\cdot V = 0{,}1 \cdot \frac{4}{1000} = 0{,}0004~\text{моль}.~ (\textit{1 балл})\]
Исходя из единицы измерения гидроксильного числа (г. ч.) — мг KOH/г, можно определить формулу для его вычисления: \[\begin{aligned} \text{г.\,ч.} = \frac{m_{\text{KOH}}}{m_{\text{ПЭГ}}} = \frac{n_{\text{KOH}} \cdot M_{\text{KOH}}}{m_{\text{ПЭГ}}} = \frac{0,0004 \cdot 56,1}{1,00} =\\= 0,02244~\text{г KOH/г} = 22,44~\text{мг KOH/г}.~(\textit{4 балла}) \end{aligned}\]
(6 баллов за пункт)
Исходя из определения г. ч. можно установить следующую взаимосвязь: на 1 моль гидроксильных групп ПЭГ приходится 1 моль KOH, тогда \[n_{\text{OH}} = n_{\text{KOH}} = \frac{\text{г.\,ч.}}{M_{\text{KOH}} \cdot 1000}.\]
В свою очередь: \[n_{\text{ПЭГ}} = \frac{n_{\text{OH}}}{2}.\]
Следовательно: \[\begin{aligned} M_{\text{ПЭГ}} = \frac{m}{n_{\text{ПЭГ}}} = \frac{2 \cdot m}{n_{\text{OH}}} = \frac{2 \cdot m \cdot M_{\text{KOH}} \cdot 1000}{\text{г.\,ч.}} =\\= \frac{2 \cdot 1,00 \cdot 56,1 \cdot 1000}{22,44} = 5000~\text{г/моль}. \end{aligned}\] (6 баллов)
Известно, что при сжигании 78 мг углеводорода A в атмосфере кислорода образуется 123,6 мл углекислого газа (объем измеряли при стандартном давлении и температуре 24 °C) и 54 мг воды. На одном из производств 1 т соединения A вводили во взаимодействие с нитрующей смесью, получая монозамещенный продукт B, на который затем действовали водородом в присутствии катализаторов, получая целевой продукт C. Общий объем реакционной смеси в реакторе составляет 2000 л.
Ход реакции контролировали методом УФ-спектрофотометрии. Анализ кривой поглощения показал два максимума поглощения при 182 нм (характерно для вещества A ) и при 230 нм (характерно для веществ A и C), что свидетельствует о неполноте прохождения первой реакции. По этой причине был проведен дополнительный количественный анализ.
Расчет проводили по закону Бугера – Ламберта – Бэра: \[D=\varepsilon l C,\] где
- \(D\) — показатель поглощения;
- \(\varepsilon\) — коэффициент молярной экстинкции, л/моль\(\cdot\)см (определяется также, как и коэффициент \(k\) в уравнении прямой);
- \(l\) — длина светового пути, см (в исследовании использовалась стандартная кювета 1 см);
- \(C\) — концентрация вещества, М.
Как указано выше, вещество A поглощает свет при двух длинах волн, в том числе при 230 нм, как и вещество C. По этой причине без учета поглощения вещества A нельзя исследовать поглощение вещества C и, как следствие, их индивидуальных концентраций.
Так как исследовалась смесь светопоглощающих веществ, важно было учесть закон аддитивности: \[D = l(\varepsilon_1 C_1 + \varepsilon_2 C_2).\]
Таким образом, были приготовлены и исследованы при двух длинах волн следующие калибровочные растворы вещества A в этаноле, см. таблицу 1.2.
| \(C\), М | \(D_{A}^{182}\) | \(D_{A}^{230}\) |
|---|---|---|
| 0 | 0,2 | 0,1 |
| 0,2 | 0,4 | 0,2 |
| 0,4 | 0,6 | 0,3 |
| 0,6 | 0,8 | 0,4 |
| 0,8 | 1 | 0,5 |
В свою очередь также были приготовлены и исследованы при одной длине волны следующие калибровочные растворы вещества C, см. таблицу 1.3.
| \(C\), М | \(D_{C}^{230}\) |
|---|---|
| 0 | 0 |
| 0,2 | 0,2 |
| 0,4 | 0,4 |
| 0,6 | 0,6 |
| 0,8 | 0,8 |
Для получения исследуемого раствора из реактора отбирали 10 мл реакционной смеси и доводили до 100 мл этанолом. Показатели поглощения исследуемого образца составили 0,3 при 182 нм и 0,6 при 230 нм.
- Определите вещества A, B и C и приведите их структурные формулы. Назовите эти вещества и напишите уравнения всех реакций, описанных выше.
- Определите степень конверсии вещества A по массе. Ответ приведите в процентах с точностью до целых.
- Определите выход продукта C. Ответ приведите в процентах с точностью до целых.
Определим количество вещества углекислого газа. Для этого нужно определить значение молярного объема при 24 °C. Воспользуемся уравнением Клапейрона: \[\begin{gather} \frac{P_{\text{ст}} V_m}{T_{\text{ст}}} = \frac{P_{\text{ст}} V_{24}}{T};\\ V_{24} = \frac{P_{\text{ст}} V_m T}{T_{\text{ст}} P_{\text{ст}}} = \frac{V_m T}{T_{\text{ст}}} = \frac{22,4 \cdot 273}{297} = 20,6. \end{gather}\]
Тогда: \[n_{\ce{CO2}} = \frac{V}{V_{24}} = \frac{123{,}6 \cdot 10^{-3}}{20{,}6} = 0{,}006\text{ моль}.~(\textit{3 балла})\]
Теперь определим количество вещества воды: \[n_{\ce{H2O}} = \frac{m_{\ce{H2O}}}{M_{\ce{H2O}}} = \frac{54 \cdot 10^{-3}}{18 \cdot 1000} = 0{,}003\text{ моль}.\]
Исходя из этого, получим количества вещества углерода и водорода: \[\begin{gather} n_C = n_{\ce{CO2}} = 0,006\text{ моль};\\ n_H = 2 \cdot n_{\ce{H2O}} = 2 \cdot 0,003 = 0,006\text{ моль}. \end{gather}\]
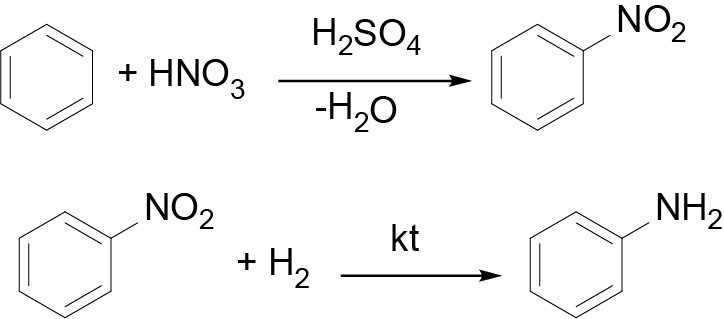
Таким образом, брутто-формула вещества A — \(\ce{C6H6}\). Это бензол.
(2,5 балла, 2 балла за расчет и 0,5 балла за название вещества)
В ходе нитрования бензола получается вещество B — нитробензол, а последующее восстановление дает вещество C — анилин.
(1 балл, по 0,5 балла за название вещества)
Приведем все уравнения реакций: \[\ce{C6H6 + 7{,}5O2 -> 6CO2 + 3H2O}.\]
Рис. 2.4.(3 балла, по 1 баллу за реакцию)
(9,5 баллов за пункт).
По приведенным данным можно легко построить калибровочные графики и установить уравнения прямых (данные позволяют сделать это по клеточкам рабочего листа):
- для вещества A (при 182 нм) — \(y = x + 0{,}2\);
- для вещества A (при 230 нм) — \(y = 0{,}5x + 0{,}1\);
- для вещества C (при 230 нм) — \(y = x\).
(3 балла, по 1 баллу за уравнение прямой)
Коэффициент перед \(x\) соответствует показателю молярной экстинкции, световой путь составляет 1 см, тогда: \[\begin{gather} D^{182} = \varepsilon_A^{182}\cdot C_A\cdot l + 0,2 = \varepsilon_A^{182} \cdot C_A + 0,2;\\ C_A = \frac{D^{182} - 0,2}{\varepsilon_A^{182}} = \frac{0,3 - 0,2}{1} = 0,1\text{ М}.~(\textit{1 балл}) \end{gather}\]
В исследуемом образце объемом 100 мл, как и в 10 мл отобранной из реактора пробы, содержится: \[n_A = C \cdot V = 0{,}1 \cdot 100 \cdot 10^{-3} = 0{,}01\text{ моль}.~(\textit{0{,}5 балла})\]
Следовательно, всего в реакторе содержится в 200000 раз больше вещества A — 2000 моль, что соответствует 156 кг (\(M = 78\) г/моль).
Рассчитаем конверсию: \[\alpha = \frac{1000 - 156}{1000} \cdot 100\% = 84\%.~(\textit{5 баллов})\]
(9,5 баллов за пункт)
Рассчитаем теперь выход продукта C: \[\begin{gather} D^{230} = \varepsilon_A^{230}\cdot C_A\cdot l + 0,1 + \varepsilon_C^{230}\cdot C_C\cdot l = 0,5 C_A + 0,1 + C_C;\\ C_C = D^{230} - 0,5 C_A - 0,1 = 0,6 - 0,5 \cdot 0,1 - 0,1 = 0,45\text{ М}.~(\textit{1 балл}) \end{gather}\]
Тогда количество вещества в 10 мл исходной пробы составит: \[n_C = C_C \cdot V = 0{,}45 \cdot 100 \cdot 10^{-3} = 0{,}045\text{ моль}.\]
А в 2000 л реактора — 9000 моль. (2 балла)
Рассчитаем количество вещества А в 1 т: \[n = \frac{m}{M} = \frac{1000000}{78} = 12820\text{ моль}.\]
Это соответствует и анилину (\(M = 93\) г/моль), тогда его теоретическая масса составит — 1192260 г. (2 балла)
Выход реакции: \[\vartheta = \frac{m_{\text{пр}}}{m_{\text{т}}} \cdot 100\% = \frac{n_C \cdot M}{m_{\text{т}}} \cdot 100\% = \frac{9000 \cdot 93}{1192260} \cdot 100\% = 70\%.~ (\textit{2 балла})\]
(6 баллов за пункт)