Предметный тур. Химия. 3 этап
В лабораторных условиях ученые пропустили смесь азота и водорода над платиной через воду, после чего прилили раствор некой кислоты.
Полученное в результате технологической операции вещество — практически готовое к применению быстрорастворимое удобрение, которое при попадании в почву распадается на ионы и закрывает значительную часть потребностей растений в питательных веществах.
Известно, что при взаимодействии с оксидом серебра описанная кислота дает характерную желтую окраску, а по химическим свойствам характеризуется как трехосновная кислота средней силы.
Запишите уравнение описанной реакции кислоты с оксидом серебра.
Какие соединения были получены при получении удобрения из смеси азота и водорода? Запишите уравнения всех описанных реакций.
Какие соединения были получены в результате всех описанных взаимодействий? Запишите их химические формулы и предложите варианты использования в химической промышленности.
Вычислите соотношения газов в смеси азота (в избытке) и водорода, если известно, что объем смеси составил 20 л (при н. у.), а объем фосфорной кислоты составил 10 мл при концентрации в 40% и плотности 1,42 г/см\(^3\). При реакции образовалась кислая соль, содержащая гидрофосфат-ион.
Запишите уравнение описанной реакции кислоты с оксидом серебра.
\[\ce{3Ag_2O + 2H_3PO_4 = 2Ag_3PO_4 + 3H_2O}. ~(\text{\textit{2 балла}})\]
Какие соединения были получены в результате превращений? Запишите их химические формулы и предложите варианты использования в сельском хозяйстве.
| Соединение | Описание | Баллы |
|---|---|---|
| \(\ce{NH_3}\) | Используется в качестве сырья для производства безводного аммиака (\(\ce{NH_3}\)). | 1 балл за формулу соединения; 1 балл за использование в химической промышленности |
| \(\ce{NH_4OH}\) | Водный аммиак применяется в качестве сырья для производства азотной кислоты (контактным методом), соды (по аммиачному методу) и удобрений. | 1 балл за формулу соединения; 1 балл за использование в химической промышленности |
| \(\ce{(NH_4)_2HPO_4}\) | Можно использовать как антипирен. Диаммонийфосфат снижает температуру горения материала, уменьшает максимальную скорость потери веса и вызывает увеличение образования остатков или полукокса. Он также используется в качестве питательного вещества для дрожжей в виноделии и медоварении; в качестве добавки к сигаретам некоторых марок, предположительно в качестве усилителя никотина; для предотвращения послесвечения в спичках; при очистке сахара; как флюс для пайки олова, меди, цинка и латуни; для контроля осаждения растворимых в щелочах и нерастворимых в кислоте коллоидных красителей на шерсти. |
1 балл за формулу соединения; 1 балл за использование в химической промышленности |
| \(\ce{H_2O}\) | Применяется во всей химической промышленности для приготовления растворов, мойки и прочих технологических операций. | 1 балл за формулу соединения; 1 балл за применение в химической промышленности |
Какие соединения были получены на каждом этапе цепочки превращений? Запишите уравнения всех описанных реакций.
\(\ce{N_2 + 3H_2 -> 2NH_3}; ~(\text{\textit{2 балла}})\)
\(\ce{NH_3 + H_2O -> NH_4OH}; ~(\text{\textit{2 балла}})\)
\(\ce{2NH_4OH + H_3PO_4 -> (NH_4)_2HPO_4 + 2H_2O}. ~(\text{\textit{2 балла}})\)
Вычислите соотношения газов в смеси азота (в избытке) и водорода, если известно, что объем смеси составил 20 л (при н. у.), а объем фосфорной кислоты составил 10 мл при концентрации в 40% и плотности 1,42 г/см\(^3\). При реакции образовалась кислая соль, содержащая гидрофосфат-ион.
\(m(\text{р-ра})=10\text{ мл} \cdot 1{,}42=14{,}2\text{ г}; ~(\text{\textit{1 балл}})\)
\(\ce{m(H_3PO_4)}=0{,}40\cdot 14{,}2=5{,}68\text{ г}. ~(\text{\textit{1 балл}})\)
- Найдем сколько грамм NH_4OH прореагировало:
\(\nu(\ce{H3PO4}) = \dfrac{5{,}68 }{98 } = 0{,}06 \, \text{моль}; ~(\text{\textit{1 балл}})\)
\(\nu(\ce{NH4OH}) = 2 \cdot \nu(\ce{H3PO4}) = 0{,}06 \cdot 2 = 0{,}12 \, \text{моль}; ~(\text{\textit{1 балл}})\)
\(m(\ce{NH4OH}) = 0{,}12 \cdot 35 = 4{,}2 \, \text{г}. ~(\text{\textit{1 балл}})\)
Найдем сколько литров водорода было в смеси:
\(\nu(\ce{H2}) = 1{,}5 \cdot \nu(\ce{NH4OH}) = 0{,}12 \cdot 1{,}5 = 0{,}18 \, \text{моль}; ~(\text{\textit{1 балл}})\)
\(V(\ce{H2}) = 22{,}4 \cdot 0{,}18 = 4{,}03 \, \text{л}. ~(\text{\textit{1 балл}})\)
Найдем процентный состав исходной смеси:
\(\omega\%(\ce{H2}) = \left( \dfrac{4{,}03 }{20 } \right) \cdot 100\% = 20{,}15\%; ~(\text{\textit{1 балл}})\)
\(\omega\%(\ce{N2}) = 100\% - 20{,}15\% = 79{,}85\%. ~(\text{\textit{1 балл}})\)
На космической ферме рассматривают различные способы получения соединений, необходимых для роста и развития растений.
Известно, что на планете Х есть в значительном количестве вещество Y. Ученые взяли пробу данного вещества объемом 0,5 л из озера в ущелье и выяснили, что плотность данного раствора составляет 1,05 г/мл.
При дальнейших исследованиях стало известно, что концентрация вещества Y в основном веществе-растворителе составляет 4,6%.
Затем через раствор в течение продолжительного времени пропускали электрический ток, в результате чего массовая доля вещества Y в растворе стала равна 10%.
Известно, что данный раствор имеет рН более 10, при взаимодействии с фенолфталеином окрашивается в малиновый.
При этом само вещество Y имеет молекулярную массу 40 г/моль и включает в свой состав металл с электронной формулой 1s2 2s2 2p6 3s1.
- Определите, что за вещество Y находится на планете Х. Запишите его формулу и дайте его описание. Какие тривиальные названия оно имеет и каким образом получается в промышленности?
- Опишите ключевые свойства и особенности взаимодействия веществ с веществом Y.
- Опишите особенности взаимодействия раствора вещества Y с метилоранжем.
- Вещество Y вступает во взаимодействие с углекислым газом из воздуха, затем происходит реакция взаимодействия с соляной кислотой. Можно ли получить из каждого из продуктов завершающей реакции вещество Y? Запишите соответствующие уравнения всех перечисленных реакций.
- Как называется процесс, в результате которого произошло описанное в задании взаимодействие под действием тока? Запишите схему данного процесса.
- Какие газы выделились на электродах и каковы их объемы?
- Опишите особенности процессов окисления и горения металла, входящего в состав вещества Y. Нужны ли для этих процессов дополнительные условия и какие? Какие еще реагенты нужны для того, чтобы реакции прошли успешно?
Определите, что за вещество Y находится на планете Х. Запишите его формулу и дайте его описание.
NaOH. (1 балл)
Это гидроксид натрия или каустическая сода или едкий натр. Относится к неорганическим соединениям. Это одно из самых сильных оснований среди химических соединений. (1 балл)
В промышленных масштабах гидроксид натрия получают путем электролиза рассола с использованием мембранной технологии. (1 балл)
Опишите ключевые свойства и особенности взаимодействия веществ с веществом Y.
Гидроксид натрия в твердом виде представляет собой белое кристаллическое вещество. С другой стороны, 50%-й раствор гидроксида натрия представляет собой прозрачную, бесцветную жидкость без запаха, которую называют натриевой щелочью. В этой форме он оказывает коррозионное воздействие на металлы. Он также характеризуется более высокой вязкостью, чем вода. Гидроксид натрия в жидком виде реагирует с кислотами, оксидами и гидроксидами неметаллов с образованием солей натрия. (2 балла)
Его характерной особенностью является гигроскопичность. Гидроксид натрия очень хорошо растворим в воде, при растворении он выделяет тепло и образует натриевую щелочь, которая обладает высокой коррозионной активностью. Он также легко соединяется с углекислым газом. (1 балл)
Опишите особенности взаимодействия раствора вещества Y с метилоранжем. Какой цвет приобретет раствор?
Раствор приобретет желтый оттенок, так как проявляет основные свойства. (1 балл)
Вещество Y вступает во взаимодействие с углекислым газом из воздуха, затем происходит реакция взаимодействия с соляной кислотой. Можно ли получить из каждого из продуктов завершающей реакции вещество Y? Запишите соответствующие уравнения всех перечисленных реакций.
Реакция 1: \(\ce{CO_2 + 2NaOH -> Na_2CO_3 + H_2O}. ~(\text{\textit{1~балл}})\)
Реакция 2: \(\ce{2HCl + Na2CO3 -> 2NaCl + H2O + CO2 ^}. ~(\text{\textit{1~балл}})\)
Продукт 1: \[\ce{2NaCl + 2H2O \text{(пропускаем эл ток)} -> H2 ^ + Cl2 ^ + 2NaOH}.~(\text{\textit{1~балл}})\]
Продукт 2: \(\ce{2H2O + 2Na -> 2NaOH + H2 ^} .~(\text{\textit{1~балл}})\)
Продукт 3: \(\ce{CO2 + Na2O -> Na2CO3}; ~(\text{\textit{1~балл}})\)
\(\ce{Na2CO3 + Ca(OH)2 -> 2NaOH + CaCO3}. ~(\text{\textit{1~балл}})\)
Как называется процесс, в результате которого произошло описанное в задании взаимодействие и выделение газообразных веществ под действием тока? Запишите схему данного процесса.
Электролиз. (1 балл)
\(\ce{NaOH -> Na+ + OH-};\)
\(\ce{H2O -> H+ + OH-}.\)
На катоде: \(\ce{2H2O + 2e- -> H2 ^ + 2OH-}\).
На аноде: \(\ce{2OH- - 4e- -> 2H+ + O2 ^}\). (2 балла)
Какие газы выделились на электродах и каковы их объемы?
Если известно, что концентрация вещества в растворе 4,6%, то вычислим полную массу раствора:
\(m_{4{,}6\% \text{ р-ра}} = 500 \cdot 1{,}05 = 525 \, \text{г}. ~(\text{\textit{1~балл}})\)
Найдем массу растворенного NaOH в 525 г раствора:
\(m_{\text{р.\,в.}} = 525 \cdot 0{,}046 = 24{,}15 \, \text{г}. ~(\text{\textit{1~балл}})\)
Найти массу 10% раствора NaOH после электролиза:
\(m_{10\% \text{ р-ра}} = \dfrac{24{,}15 }{0{,}1} = 241{,}5 \, \text{г}. ~(\text{\textit{1~балл}})\)
Найдем сколько литров \(\ce{H2}\) и \(\ce{O2}\) выделилось:
\(\nu(\ce{O2}) = \dfrac{15{,}75 }{2} = 7{,}875 \, \text{моль}; ~(\text{\textit{1~балл}})\)
\(\nu(\ce{H2}) = \dfrac{283{,}5 }{18 } = 15{,}75 \, \text{моль}; ~(\text{\textit{1~балл}})\)
\(V(\ce{O2}) = 7{,}875 \cdot 22{,}4 = 176{,}4 \, \text{л}; ~(\text{\textit{1~балл}})\)
\(V(\ce{H2}) = 15{,}75 \cdot 22{,}4 = 352{,}8 \, \text{л}.~(\text{\textit{1~балл}})\)
Опишите особенности процессов окисления и горения металла, входящего в состав вещества Y. Нужны ли для этих процессов дополнительные условия и какие, если да? Какие еще реагенты нужны для того, чтобы реакции прошли успешно?
Окисление: металлический натрий реагирует с кислородом воздуха, образуя оксид натрия и следы желтоватого пероксида натрия; образовавшийся оксид натрия затем реагирует с водяным паром в воздухе, образуя пленку гидроксида натрия. (1 балл)
Горение: \(\ce{2Na + O_2 -> Na_2O_2}\) (при нагревании до 400 °С). (1 балл)
Для контроля качественных и количественных параметров раствора в зоне приготовления питательных сред лаборанты используют системы контрольно-измерительных приборов.
Полученные данные передают в единую электронную базу, где операторы собирают и обрабатывают их с применением определенных алгоритмов накопления и анализа данных.
С целью удешевления используемого оборудования тестируются различные материалы датчиков.
Так, одинаковые цинковые электроды длиной 100 мм и массой 65 г были помещены в три одинаковых емкости, в каждой из которых находилось по 100 г прозрачной жидкости.
В первой емкости находился 20%-й раствор соляной кислоты, во второй — горячая водопроводная вода, а в третьей — 2%-й раствор гидроксида натрия.
Спустя несколько часов электроды вынули из растворов, промыли дистиллированной водой, просушили и обследовали на предмет коррозии и изменения целостности поверхностей. Визуальный осмотр показал, что заметных следов на поверхности электродов не осталось, однако один из них потерял 10% от исходной массы.
- Запишите химические формулы веществ, находящихся в водных растворах в каждой из емкостей. Дайте краткую характеристику каждому из описанных веществ.
- Какое из перечисленных веществ вступило в реакцию с электродом? Запишите уравнение реакции.
- Вычислите массовую долю непрореагировавшего вещества, находившегося в емкости и оставшегося в растворе. Ответ дайте с точностью до целого числа.
- Повлияет ли подобное взаимодействие веществ с материалами датчиков на качество приготовляемых растворов на производстве? Каким образом можно установить факт существования данного влияния с помощью химии или исходя из условий задачи? Приведите не менее трех способов.
- Каким образом нужно изменить условия, чтобы в других емкостях произошла химическая реакция с материалом электрода? Запишите не менее одной возможной химической реакции при измененных условиях для каждого раствора.
- Дайте рекомендации по не менее, чем двум металлам, из которых, на ваш взгляд, наиболее безопасно изготавливать датчики. Опишите их свойства.
- К какому классу веществ относится латунь? Можно ли использовать ее в щелочных растворах? А в кислых? Почему? Запишите химическую формулу латуни и опишите ее разновидности.
Запишите химические формулы веществ, находившихся в растворах в каждой из емкостей. Дайте краткую характеристику каждому из описанных веществ.
Примеры решения
HCl. (1 балл)
Соляная кислота (также хлороводородная кислота, химическая формула — HCl) — химическое соединение водорода и хлора, растворенное в воде; сильная неорганическая кислота. Благодаря своим химическим свойствам она широко используется в промышленности, аналитической химии и других сферах человеческой деятельности. (2 балла)
NaOH. (1 балл)
Гидроксид натрия — белое твердое вещество. Сильно гигроскопичен, на воздухе «расплывается», активно поглощая пары воды и углекислый газ из воздуха. Хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь. Гидроксид натрия широко используется в химической промышленности. Он используется в производстве многих чистящих средств, мыла и моющих средств. Кроме того, применяется для дренажа труб и очистки воды. В пищевой промышленности он является регулятором кислотности. (2 балла)
Какое из перечисленных веществ вступило в реакцию с электродом? Запишите уравнение реакции.
\[\ce{2HCl + Zn -> ZnCl_2 + H_2 ^ }.~ (\text{\textit{2~балла}})\]
Вычислите массовую долю непрореагировавшего вещества, находившегося в емкости и оставшегося в растворе. Ответ дайте с точностью до целого числа.
Найдем массу \(\ce{HCl}\) содержащейся в 100 г 20% раствора:
\[m(\ce{HCl})=100\cdot 0{,}2=20\,\text{г}. ~(\text{\textit{1~балл}})\]
- Цинковая пластинка реагирует с соляной кислотой по уравнению: \[\ce{2HCl + Zn -> ZnCl_2 + H_2 ^ }.\]
Найдем сколько HCl вступило в реакцию, зная, что 6,5 г Zn прореагировало:
\[\nu(\ce{Zn})=6{,}5:65=0{,}1 \text{ моль} ;~(\text{\textit{1~балл}})\] \[\nu(\ce{HCl})=2\cdot 0{,}1=0{,}2\text{ моль} ;~(\text{\textit{1~балл}})\] \[m(\ce{HCl})=0{,}2\cdot 36{,}5 =7{,}3\text{ г} .~(\text{\textit{1~балл}})\]
- Найдем, сколько \(\ce{HCl}\) осталось в растворе: \[m_{\text{ост}}(\ce{HCl})=20-7{,}3=12{,}7\text{ г} .~(\text{\textit{1~балл}})\]
- Найдем общую массу раствора: \[m_{\text{р-ра}} = 100\text{ г}(\ce{HCl})+6{,}5\text{ г}(\ce{Zn})-m(\ce{H_2}),\] \[m(H_2)=0{,}1\cdot 2=0{,}2 \text{ г},~(\text{\textit{1~балл}})\] тогда \[m_{\text{р-ра}} = 100+6{,}5-0{,}2=106{,}3\text{ г} .~(\text{\textit{1~балл}})\]
- Найдем \(\omega\)% оставшейся \(\ce{HCl}\): \[\omega \%(\ce{HCl})=(12{,}7:106{,}3)\cdot 100\%=11{,}9\% .~(\text{\textit{1~балл}})\]
Повлияет ли подобное взаимодействие веществ с материалами датчиков на качество приготовляемых растворов на производстве? Каким образом можно установить факт существования данного влияния с помощью химии?
Да, точность датчиков будет нестабильна, как и их целостность, а в растворах будут образовываться посторонние вещества. (1 балл)
Качество полученного продукта на любом производстве контролируется в соответствии с нормами и требованиями. На выходном контроле лабораторные исследования, скорее всего, покажут несоответствие ожидаемым параметрам. (1 балл)
Для определения наличия постороннего вещества можно использовать качественные реакции на наличие/отсутствие примеси определенного состава, а также отслеживать появление характерных признаков самопроизвольного прохождения подобной реакции (выпадение осадка, изменение цвета раствора, выделение газа и т. д.). (1 балл)
Также в задании упомянуто, что полученные данные передают в единую электронную систему, где операторы собирают и обрабатывают их с применением определенных алгоритмов накопления и анализа данных. То есть изменение параметра, выпадающее за пределы нормы будет замечено системой. (1 балл)
Каким образом нужно изменить условия, чтобы в других емкостях произошла химическая реакция с материалом электрода? Приведите не менее одной возможной химической реакции при измененных условиях.
Концентрированная щелочь вступит во взаимодействие с металлом:
\[\ce{Zn + 2NaOH_{\text{конц}} + 2H2O -> Na2[Zn(OH)4] + H2 ^} .~(\text{\textit{2~балла}})\]
Цинк вступит в химическую реакцию с водой в случае прокаливания водяным паром:
\[\ce{Zn + H_2O -> ZnO + H_2 }.~(\text{\textit{2~балла}})\]
Дайте рекомендации по материалу, из которого, на ваш взгляд, наиболее безопасно изготавливать датчики для данного производства.
Пример ответа
Платина, как наиболее стабильный и не вступающий в реакции электрод. (1 балл)
Нержавеющая сталь или любой другой металл, покрытый никелем или полимером.
К какому классу веществ относится латунь? Можно ли использовать ее в щелочных растворах? А в кислых? Почему? Запишите химическую формулу латуни и опишите ее разновидности.
Примеры верных ответов
Латунь — сплав металлов (медь и цинк). (1 балл)
Латунь — сплав меди (основа) с цинком (4–50 % по массе). При увеличении содержания цинка (Zn) цвет сплава изменяется от красноватого до светло-желтого.
Латуни обладают хорошей коррозионной стойкостью в атмосферных условиях. Однако латуни, содержащие более 20 % цинка, подвержены особым видам коррозии: обесцинкованию и межкристаллитному (или «сезонному») растрескиванию.
Обесцинкование проявляется при контакте латуни с электропроводящими средами (кислыми и щелочными растворами); сопровождается ухудшением свойств и качества поверхности латунных изделий (снижаются механические свойства, появляются красноватые пятна на поверхности). (3 балла, по одному за описание контакта с кислой средой, щелочной средой и обоснование позиции, жирным выделен минимальный ответ)
По химическому составу латуни делят на двойные, не содержащие легирующих добавок, их формула выглядит как Cu- Zn или CuZn и специальные (многокомпонентные), в которые для улучшения свойств вводят в небольших количествах (1–2 %, реже до 4 %) легирующие добавки алюминия (Al), марганца (Mn), железа (Fe), никеля (Ni), кремния (Si), свинца (Pb), мышьяка (As) и др. (2 балла, жирным выделен минимальный ответ)
На медицинском производстве в тестовый реактор-смеситель, в котором находится 250 г воды, согласно рецептуре приготовления лекарственного средства добавили несколько граммов металла.
Известно, что данный металл можно выделить из такого минерала как сподумен. Также он наблюдается в очень высоких концентрациях в космосе, в звездных образованиях особого типа, в состав которых входят нейтронные звезды и красные карлики.
Металл, непосредственно добавленный в реактор, был получен из загрязненной нефтепродуктами морской воды. Для осуществления качественной очистки от загрязнителя воду с принудительно пропускали через системы фильтрации и механической очистки.
В процессе отработки технологии очистки было замечено, что существует возможность выделить ряд сопутствующих ценных веществ и соединений.
В их числе был и данный металл, необходимый в медицине и психиатрии. Чаще всего он применяется в составе лекарственных средств, предназначенных для лечения биполярного расстройства и психозов.
Для выделения металла, добавленного в биореактор, было использовано 15000 л морской воды, причем известно, что в 3 м\(^3\) этой же воды содержится 500 мг металла.
- О каком металле идет речь? Назовите его и опишите ключевые свойства.
- Рассчитайте содержание металла в 1 л морской воды, из которой его выделили. Дайте ответ в миллиграммах на литр с точностью до десятых.
- Определите массовую долю метала в получившемся в биореакторе растворе.
Вычислите, какой объем серной кислоты концентрацией 10% нужно добавить в полученный биореакторе раствор, чтобы довести его кислотность до нейтрального значения.
Плотность морской воды при расчетах примите равной 1030 кг/м\(^3\), плотность серной кислоты (10%) — 1065 кг/м\(^3\).
Известно, что процесс получения гидроксида данного металла можно провести в два этапа, причем на втором произойдет взаимодействие промежуточного вещества Х с водой. В случае, если цепочку превращений прервать на первом этапе, может произойти взаимодействие вещества Х с углекислым газом.
Можно ли получить вещество Х из солей?
- Опишите физические свойства вещества Х при стандартных условиях. Можно ли снова получить из него металл?
Литий. (1 балл)
Литий — металл серебристо-белого цвета, очень мягкий, его можно резать ножом. Реагирует с водой, образуя растворимый гидроксид — щелочь. Входит в группу щелочных металлов I группы главной подгруппы. (1 балл)
В 15000 л содержится \(500\cdot 15000 / 3000 = 500 \cdot 5 = 2500\) мг металла.
В 1 л содержится \(2500/15000 = 1{,}17\) мг/л. (1 балл)
Определите массовую долю метала в получившемся в биореакторе растворе.
\[\ce{2Li + 2H2O -> 2LiOH + H2 ^}. ~\text(\textit{1 балл})\]
Найдем массу образовавшегося \(\ce{LiOH}\): \[\ce{2LiOH + H2SO4 -> Li2SO4 + 2H2O}; ~\text(\textit{1 балл})\] \[\nu(\ce{LiOH})=\nu(\ce{Li})=0{,}36 \text{ моль}; ~\text(\textit{1 балл})\] \[m(\ce{LiOH})=0{,}36\cdot 24=8{,}64\text{ г}; ~\text(\textit{1 балл})\] \[m_{\text{р-ра}}=2{,}5 + 250 = 252{,}5\text{ г}. ~\text(\textit{1 балл})\]
Потери массы обусловлены образованием водорода массой 0,36 г, т. е. масса конечного раствора 252,14 г. (1 балл).
Найдем \(\omega\)% LiOH: \[\omega\%(\ce{LiOH})=(8{,}64:252{,}14)\cdot 100\%=3{,}43\%. ~\text(\textit{1 балл})\]
Вычислите, какой объем серной кислоты концентрацией 10% нужно добавить в полученный в биореакторе раствор, чтобы довести его кислотность до нейтрального значения. \[\ce{2LiOH + H2SO4 -> Li2SO4 + 2H2O};~ (\textit{1 балл})\] \[m(\ce{H2SO4})=(0{,}36:2)\cdot 98=17{,}64\text{ г}. ~\text(\textit{1 балл})\]
- Найдем массу 10% раствора \(\ce{H_2SO_4}\): \[m_{\text{р-ра}} = 17{,}64:0{,}1=176{,}4\text{ г}. ~\text(\textit{1 балл})\]
- Найдем \(V(\ce{H2SO4})\): \[V(\ce{H2SO4})=176{,}4:1{,}065=165{,}6\text{ мл}. ~\text(\textit{1 балл})\]
\[\ce{4Li + O2 -> 2Li2O}; ~\text(\textit{1 балл})\] \[\ce{Li2O + H2O -> 2LiOH}; ~\text(\textit{1 балл})\] \[\ce{Li2O + CO2 -> Li2CO3}. ~\text(\textit{1 балл})\]
Его получают также прокаливанием нитрата лития \(\ce{LiNO_3}\) при 600 °C в присутствии Сu, \(\ce{LiNO_2}\) — при 190 °C, карбоната лития \(\ce{Li_2CO_3}\) — при 700 °C в токе высушенного \(\ce{H2}\). (1 балл)
Оксид лития — это белое, гигроскопичное, тугоплавкое вещество, при нагревании не разлагается.
Относительная молекулярная масса равна 29,88; относительная плотность для тв. и ж. состояния равна 2,013; \(t_{\text{пл}}= 1453 °\)C; \(t_\text{кип}\approx 2600 °\)C. (1 балл)
Литий из оксида можно получить восстановлением магнием при 800 °C: \[\ce{Li_2O + Mg -> 2Li + MgO}. ~\text(\textit{1 балл})\]
В фотобиореакторе находится смесь оксигенных и аноксигенных микроорганизмов, образцы которых были получены во время экспедиции на Марс.
Известно, что в процессе жизнедеятельности данные микроорганизмы выделяют газовоздушную смесь неизвестного состава, для отвода которой установлена трубка, ведущая в шарообразную емкость-отстойник диаметром 26,74 см. Кроме того, в фотобиореакторе выпадает твердый осадок, который отфильтровывается и также отправляется в емкость-отстойник для сбора побочных продуктов культивирования.
В процессе культивирования в данную емкость поступило вещество Х и пары вещества Y в пропорции \(1:2\) по массе, после чего в емкости-накопителе произошла химическая реакция с образованием соединения N.
Известна схема строения атома, характерная для элементов, входящих в состав Х — это 1s2 2s2 2p6 3s2 3p4.
Также есть информация, что Y — это газообразное вещество, в промышленных масштабах производимое из воздуха с применением ректификационных колонн при температуре \(-183~°\)С. Его можно получить разложением перманганата калия при нагревании в лабораторных условиях.
- Что представляет собой соединение Х? Запишите его химическую формулу и опишите качественную реакцию на данное соединение.
- Что обозначают цифры и буквы в предложенной схеме строения атома? Что доказывает, что данная схема подойдет только элементам, характерным для Х?
- Какие вещества образуются при взаимодействии Х с галогенами? Имеются ли исключения из данного правила или дополнительные условия? Запишите не менее одной химической реакции.
- Что представляет собой соединение Y? Запишите его химическую формулу и опишите качественную реакцию на данное соединение.
- Какие еще соединения образуются в каждом из указанных способов получения Y?
- Каким образом Y взаимодействует с щелочными металлами? Запишите не менее одной химической реакции с пояснениями.
- Что представляет собой соединение N? Запишите химическую реакцию, произошедшую после попадания Х и Y в емкость-накопитель. Укажите степени окисления каждого из вступивших в реакцию веществ.
- Известно, что вещество N можно использовать в первом этапе химического цикла получения водорода. Для этого необходимо добавить йод и воду. В результате химической реакции продукты реакции разделяются на два жидких слоя. Что находится в каждом из слоев (верхнем и нижнем)?
- Данная реакция названа в честь ученого, открывшего его в середине XIX века и лежит в основе классического метода определения малого количества воды по Фишеру. О каком ученом идет речь? Как в аналитической химии называется описанный метод и используется ли он в современной лабораторной практике?
- Вычислите исходную концентрацию Х и Y в емкости-накопителе, если известно, что массы веществ Х и Y в начальный момент времени составили соответственно 3,2 и 6,4 г. Ответ дайте в моль на литр с точностью до тысячных.
- Вычислите концентрацию паров X, которые остались после вступления соединения в химическую реакцию. Ответ дайте в моль на литр с точностью до тысячных.
- Вычислите соотношение значений скорости реакции в начальный момент времени и в момент, когда уже вступила во взаимодействие 1/10 вещества Х. В ответ запишите полученное значение с точностью до десятых.
Что представляет собой соединение Х? Запишите его химическую формулу и опишите качественную реакцию на данное соединение.
S — сера. (1 балл)
Сера горит синим пламенем с выделением серы диоксида, который определяется по характерному запаху. (1 балл)
Что обозначают цифры и буквы в предложенной схеме строения атома? Что доказывает, что данная схема подойдет только элементам, характерным для Х?
Схема электронного строения показывает количество уровней в атоме и распределение электронов по энергетическим уровням и подуровням. (1 балл)
1s2 2s2 2p6 3s2 3p4: три электронных уровня (равно периоду), на внешнем уровне sp шесть электронов (равно номеру группы для главных подгрупп). Ядро атома серы содержит 16 протонов (равно заряду ядра) и 16 нейтронов (атомная масса минус число протонов: \(32 - 16 = 16\)). (2 балла)
16 — порядковый номер серы. Данная структура подходит только данному элементу. (1 балл)
Какие вещества образуются при взаимодействии Х с галогенами? Имеются ли исключения из данного правила или дополнительные условия? Запишите не менее одной химической реакции.
При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы: (1 балл)
\[\ce{S + Cl_2 -> SCl_2 (S_2Cl_2)};~ (\textit{1~балл})\] \[\ce{S + 3F_2 -> SF_6}.\]
Что представляет собой соединение Y? Запишите его химическую формулу и опишите качественную реакцию на данное соединение.
\(\ce{O_2}\) — кислород. (1 балл)
Качественная реакция на кислород — яркое загорание тлеющей лучинки или любая реакция горения. (1 балл)
Какие еще соединения образуются в каждом из указанных способов получения Y? \[\ce{2KMnO_4 -> K_2MnO_4 + MnO_2 + O_2 ^}.\]
\(\ce{K_2MnO_4}\) — манганат калия. (1 балл)
\(\ce{MnO_2}\) — оксид марганца (IV), диоксид марганца. (1 балл)
Каким образом Y взаимодействует с щелочными металлами? Запишите не менее одной химической реакции с пояснениями.
На воздухе блестящая поверхность щелочных металлов тускнеет вследствие окисления, а рубидий и цезий воспламеняются. Характерно, что основными продуктами сгорания щелочных металлов чаще всего являются не оксиды (\(\ce{M_2O}\)), а пероксиды (\(\ce{M_2O_2}\)). (2 балла, 1 балл за реакцию с пояснениями)
- Литий с кислородом при нормальной температуре не реагирует. При нагревании литий сгорает с образованием белой окиси и лишь небольшого количества пероксида, что отличает его от других щелочных металлов.
- При сгорании в кислороде натрий, как типичный щелочной металл, дает пероксида натрия и небольшое количество оксида.
- В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды. При нагревании калий загорается с образованием надпероксида и незначительного количества пероксида и оксида.
Что представляет собой соединение N? Запишите химическую реакцию, произошедшую после попадания Х и Y в емкость-накопитель. Укажите степени окисления каждого из вступивших в реакцию веществ.
\(\ce{S^0 + O2^0 -> S^{+4}O2^{-2}}\). (1 балл за реакцию и 1 балл за степени окисления)
\(\ce{SO_2}\) — оксид серы (IV) (диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид) — соединение серы с кислородом. (1 балл)
Известно, что вещество N можно использовать в первом этапе химического цикла получения водорода. Для этого необходимо добавить йод и воду. В результате химической реакции продукты реакции разделяются на два жидких слоя. Запишите данную химическую реакцию. Что находится в каждом из слоев (верхнем и нижнем)?
Реакция Бунзена — химическая реакция, в результате которой вода, диоксид серы и йод образуют серную кислоту и йодистый водород:
\[\ce{2H2O + SO2 + I2 -> H2SO4 + 2HI}. ~(\textit{2~балла})\]
Эта реакция является первым этапом серо-йодного цикла по производству водорода. Продукты разделяются на два жидких слоя, где серная кислота плавает наверху, а смесь йодистого водорода и непрореагировавшего йода находится внизу. Хотя два слоя обычно считаются несмешивающимися, небольшие количества серной кислоты могут все еще оставаться в слое йодистого водорода и наоборот. Это может привести к нежелательным побочным реакциям, одна из которых выделяет серу, что может стать причиной засорения реакционного сосуда. (2 балла, по 1 за каждый слой)
Данная реакция названа в честь ученого, открывшего ее в середине XIX века и подобная реакция лежит в основе классического метода определения малого количества воды по Фишеру. О каком ученом идет речь? Как в аналитической химии называется описанный метод и используется ли он в современной лабораторной практике?
Реакция названа в честь Роберта Бунзена, который открыл ее в 1853 году. (1 балл)
Подобная реакция является основой для титрования по Фишеру.
Титрование по Карлу Фишеру — классический метод титрования в аналитической химии, используемый для определения малого количества воды в анализируемой пробе. Метод был разработан в 1935 году немецким химиком Карлом Фишером. (2 балла)
В настоящее время используются два варианта метода: кулонометрический и волюметрический (объемный). (1 балл)
Вычислите исходную концентрацию Х и Y в емкости-накопителе, если известно, что массы веществ Х и Y в начальный момент времени составили соответственно 3,2 и 6,4 г. Ответ дайте в моль на литр с точностью до тысячных.
26,74 см — диаметр шара.
\(V_\text{шара} = 4/3 \cdot \pi \cdot R ^3.\)
\(V_\text{шара} = 10006\) см\(^3 = 10\) л. (1 балл)
Найдем исходные концентрации серы и кислорода:
\(C(S)=(3{,}2:32):10=0{,}01\) моль/л. (1 балл)
\(C(O)=(6{,}4:32):10=0{,}02\) моль/л. (1 балл)
Вычислите концентрацию X, оставшегося после вступления соединения в химическую реакцию. Ответ дайте в моль на литр с точностью до сотых.
Сера, которая вступила в реакцию:
\(m{(S \text{вст в реакц})}=3{,}2\cdot 0{,}1=0{,}32\) г. (1 балл)
Сера, которая осталась после реакции:
\(m{(S \text{остались})}=3{,}2-0{,}32=2{,}88\) г. (1 балл)
Найдем концентрацию оставшейся серы:
\(C(S)=(2{,}88:32):10=0{,}009\) моль/л. (1 балл)
Тогда масса кислорода:
\(m(\ce{O2} \text{ вступ. в реакц.}) = (0{,}36:32)\cdot 32 = 0{,}36~ \text{г}\).
\(m{(\ce{O2} \text{ ост})}=6{,}4-0{,}32=6{,}08\) г. (1 балл)
Концентрация кислорода, который остался:
\(C(\ce{O2})=(6{,}08:32):10=0{,}019\) моль/л. (1 балл)
Вычислите соотношение значений скорости реакции в начальный момент времени и в момент, когда уже вступила во взаимодействие 1/10 вещества Х. В ответ запишите полученное значение с точностью до десятой.
Вычислим начальную скорость реакции:
\(V_1=K\cdot [S]\cdot [\ce{O2}],~ V_1=K\cdot 0{,}01\cdot 0{,}02=0{,}0002\cdot K.\) (1 балл)
Вычислим скорость реакции, когда прореагирует 1/10 серы:
\(V_2=K\cdot [S]\cdot [\ce{O2}],~ V_2=K\cdot 0{,}009\cdot 0{,}019=0{,}000171\cdot K\). (1 балл)
\(V1:V2=(0{,}0002\cdot K):(0{,}000171\cdot K)=1{,}17\) раз (уменьшилась). (1 балл)
В аналитической лаборатории в результате смешения стоков рыбохозяйственного предприятия и предприятия, производящего антибиотики, было получено вещество Х, активно используемое для производства удобрений. Попадая в почву, само вещество Х положительно влияет на устойчивость растений к заморозкам и засухе.
Для того чтобы получить смеси данных веществ в лабораторных условиях ученые пропустили смесь азота и водорода над платиной и через воду, после чего прилили раствор фосфорной кислоты.
Какие соединения были получены в результате всех описанных взаимодействий? Приведите их химические формулы и предложите варианты использования в сельском хозяйстве.
Какие соединения были получены на каждом этапе цепочки превращений? Запишите уравнения всех описанных реакций.
Вычислите соотношения газов в смеси азота (в избытке) и водорода, если известно, что объем смеси составил 50 л (при н. у.), а объем фосфорной кислоты составил 60 мл при концентрации в 58% и плотности 1,42 г/см\(^3\). При расчетах учтите, что в растворе образовался гидрофосфат-ион.
Какие вещества, применяемые в качестве удобрений и являющиеся промежуточными продуктами цепочки превращений, содержатся в стоках медицинских и рыбохозяйственных предприятий? Приведите не менее двух примеров и опишите откуда они там берутся.
Какие соединения были получены в результате превращений? Запишите их химические формулы и предложите варианты использования в сельском хозяйстве.
| Соединение | Описание | Баллы |
|---|---|---|
| \(\ce{NH3}\) | Используется в качестве сырья для производства безводного аммиака (\(\ce{NH3}\)). Это самое концентрированное из всех существующих азотное удобрение, содержащее 82,2% азота. Внешне — это бесцветная подвижная жидкость с резким запахом, которая при температуре 34 °С на воздухе бурно кипит, а при 77 °С — быстро испаряется. | 1 балл за формулу соединения; 1 балл за описание |
| \(\ce{NH4OH}\) | Водный аммиак представляет собой прозрачную бесцветную жидкость, иногда с легким желтоватым оттенком. Для вещества характерен резкий удушающий запах. Молярная масса \(\ce{NH4OH}\) равна 35,046 г/моль. 25%-й раствор аммиака имеет плотность 0,91 г/мл. Водный аммиак применяется в качестве основного удобрения под все сельскохозяйственные культуры, а также для подкормки пропашных культур при междурядной обработке почвы. | 1 балл за формулу соединения; 1 балл за описание |
| \(\ce{(NH4)2HPO4}\) | Диаммофос (\(\ce{(NH4)2HPO4}\)) — быстрорастворимое удобрение, при попадании в почву распадается на ионы \(\ce{NH4+}\), \(\ce{H2PO4-}\), \(\ce{HPO4^2-}\) и \(\ce{PO4^3-}\). Диаммофос подходит как стартовое удобрение как осенью, так и особенно весной из-за быстрого растворения, а также для подкормок в смеси с селитрой. | 1 балл за формулу соединения; 1 балл за описание |
| \(\ce{H2O}\) | Вода применяется как универсальный растворитель и необходима для полива растений. | 1 балл за формулу соединения; 1 балл за описание |
Какие соединения были получены на каждом этапе цепочки превращений? Запишите уравнения всех описанных реакций.
\(\ce{N2 + 3H2 -> 2NH3}\); (1 балл)
\(\ce{NH3 + H2O -> NH4OH}\); (1 балл).
\(\ce{2NH4OH + H3PO4 -> (NH4)_2HPO4 + 2H2O}\). (1 балл).
Вычислите соотношения газов в смеси азота и водорода, если известно, что объем смеси составил 50 л (при н. у.), а объем фосфорной кислоты составил 60 мл при концентрации в 58% и плотности 1,42 г/см\(^3\). При расчетах учтите, что в растворе образовался гидрофосфат-ион.
Найдем массу \(\ce{H3PO4}\) в растворе:
\(m(\text{р-ра}) = 60 \cdot 1{,}42 = 85{,}2 \, \text{г}\); (1 балл)
\(m(\ce{H3PO4}) = 0{,}58 \cdot 85{,}2 = 49{,}4 \, \text{г}\). (1 балл)
Найдем, сколько грамм \(\ce{NH4OH}\) прореагировало:
\(\nu(\ce{H3PO4}) = 49{,}4 : 98 = 0{,}5 \, \text{моль}\); (1 балл).
\(\nu(\ce{NH4OH}) = 2 \cdot \nu(\ce{H3PO4}) = 0{,}5 \cdot 2 = 1 \, \text{моль}\); (1 балл)
\(m(\ce{NH4OH}) = 1 \cdot 35 = 35 \, \text{г}\). (1 балл)
Найдем, сколько литров водорода было в смеси:
\(\nu(\ce{H2}) = 1{,}5 \cdot \nu(\ce{NH4OH}) = 1 \cdot 1{,}5 = 1{,}5 \, \text{моль}\); (1 балл)
\(V(\ce{H2}) = 22{,}4 \cdot 1{,}5 = 33{,}6 \, \text{л}\). (1 балл)
Найдем процентный состав исходной смеси:
\(\omega\%(\ce{H2}) = 33{,}6: 50 \cdot 100\% = 67{,}2\%\); (1 балл)
\(\omega\%(\ce{N2}) = 100 - 67{,}2 = 32{,}8\%\). (1 балл)
67,2% водорода и 32,8% азота в смеси.
Железобактерии — это прокариотические микроорганизмы, которые способны окислять \(\ce{Fe2+}\).
Часть из них — это аэробные облигатно ацидофильные железобактерии, способные накапливать в среде трехвалентное железо в виде гидроксида железа (II) или сульфата железа (III).
Они активно используются в добывающей промышленности для проведения процесса выщелачивания полезных металлов.
В результате генетических манипуляций ученые вывели новый вид железобактерий, которые способны выделять сульфат железа (II).
Запишите химические формулы всех перечисленных веществ — гидроксида железа (II), сульфата железа (III), сульфата железа (II).
Для выделения железа провели два эксперимента — полный электролиз сульфата железа (III) и сульфата железа (II). Вычислите массу кислорода, полученного в первом и втором случае, если известно, что на катоде в обоих случаях выделилось по 56 г железа.
- Запишите химические реакции полного электролиза сульфата железа (III).
- Запишите химические реакции полного электролиза сульфата железа (II).
Какие вещества выделились на анодах в первом и втором случае?
Запишите их химические формулы. Из каких химических элементов они состоят? Перечислите их и укажите периоды согласно таблице Менделеева. Чем определяется номер периода для элементов таблицы?
- Вычислите массу фосфора, который сможет вступить во взаимодействие с веществом, выделившимся на аноде при эксперименте по электролизу сульфата железа (II).
- Какое вещество получится, если продукт реакции (описанной в пункте 4) растворить в воде? Вычислите его молекулярную массу и занесите в ответ с точностью до целого числа.
- Вычислите массовую долю полученного в пункте 4 вещества при добавлении к нему 206 г воды. Какими свойствами будет обладать данный раствор?
Запишите химические реакции полного электролиза сульфата железа (III).
Реакция:
\(\ce{Fe2(SO4)3 <=> 2Fe^{3+} + 3SO4^{2-}}\); (1 балл)
\(\text{К(-): } \ce{Fe^{3+} + 3e- -> Fe}\); (1 балл)
\(\text{А(+): } \ce{2H2O - 4e- -> O2 ^ + 4H+}\); (1 балл)
\(\ce{2Fe2(SO4)3 + 6H2O -> 4Fe + 3O2 ^ + 6H2SO4}\). (1 балл)
Запишите химические реакции полного электролиза сульфата железа (III).
Вторая реакция:
\(\ce{FeSO4 <=> Fe^{2+} + SO4^{2-}}\); (1 балл)
\(\text{К(-): } \ce{Fe^{2+} + 2e- -> Fe}\); (1 балл)
\(\text{К(-): } \ce{2H2O + 2e- -> H2 ^ + 2OH-}\) (реакция на катоде, на катоде происходит восстановление); (1 балл)
\(\text{А(+): } \ce{2H2O - 4e- -> O2 ^ + 4H+}\) (реакция на аноде, на аноде происходит окисление); (1 балл)
\(\ce{Fe^{2+} + 2H2O -> Fe + H2 ^ + O2 ^ + 2H+}\);
\(\ce{FeSO4 + 2H2O -> Fe + H2 ^ + O2 ^ + H2SO4}\). (1 балл)
Какие вещества выделились на электродах в первом и втором случае? Запишите их химические формулы.
- \(\ce{O2}\); (1 балл)
- \(\ce{Fe}\); (1 балл)
- \(\ce{H2SO4}\). (1 балл)
Из каких химических элементов они состоят? Перечислите их и укажите периоды согласно таблице Менделеева.
Элемент Период Балл Fe 4 1 O 2 1 H 1 1 S 3 1 Чем определяется номер периода для элементов таблицы? (1 балл)
Номер периода, к которому относится химический элемент, определяется числом его электронных оболочек (энергетических уровней).
Вычислите массу фосфора, который сможет вступить во взаимодействие с веществом, выделившимся на аноде при эксперименте по электролизу сульфата железа (II).
Сначала найдем массу \(\ce{O2}\), выделившегося на аноде, зная, что на катоде выделилось 56 г Fe:
\(\nu(\ce{Fe}) = 56 : 56 = 1 \, \text{моль}\); (1 балл)
\(\nu(\ce{O2}) = \nu(\ce{Fe}) = 1 \, \text{моль}\);
\(m(\ce{O2}) = 1 \cdot 32 = 32 \, \text{г}\). (1 балл)
Найдем массу фосфора, прореагировавшего с 32 г кислорода:
\(\ce{4P + 5O2 -> 2P2O5}\);
\(\nu(\ce{P}) = ( 1 :5) \cdot 4 = 0{,}8 \, \text{моль}\); (1 балл)
\(m(\ce{P}) = 0{,}8\cdot 31 = 24{,}8 \, \text{г}\). (1 балл)
Какое вещество получится, если продукт реакции (описанной в пункте 4) растворить в воде? Вычислите его молекулярную массу и занесите в ответ с точностью до целого числа.
\(\ce{H3PO4}\) — молекулярная масса 98 г/моль. (1 балл)
Вычислите массовую долю полученного в пункте 4 вещества при добавлении к нему 206 г воды. Какими свойствами будет обладать данный раствор?
Найдем массу полученной кислоты:
\(\ce{P2O5 + 3H2O -> 2H3PO4}\); (1 балл)
\(\nu(\ce{H3PO4}) = \nu(\ce{P}) = 0{,}8 \, \text{моль}\); (1 балл)
\(m(\ce{H3PO4}) = 98 \cdot 0{,}8 = 78{,}4 \, \text{г}\). (1 балл)
Найдем массовую долю кислоты в полученном растворе:
\(m(\text{р-ра}) = 206 + 78{,}4 = 284{,}4 \, \text{г}\); (1 балл)
\(\omega\%(\ce{H3PO4}) = \left( \dfrac{78{,}4}{284{,}4} \right) \cdot 100\% = 27{,}57\%\). (1 балл)
Раствор будет являться раствором кислоты средней силы с массовой долей 27,57%.
На гидропонной установке выращивают сырье для получения лекарственного препарата. Помимо организации процесса роста и развития растения, а также подбора оптимальных режимов выращивания на количество и качество получаемого целевого продукта влияет эффективность процессов сбора и переработки растительного сырья.
Так, после сбора всей биомассы растений необходимо отделить лишние и непродуктивные части (сухие или подгнившие части растений, а также части, не содержащие целевого продукта или нужного компонента). Затем биомасса подвергается промывке, просушиванию, измельчению до нужной консистенции и выделению необходимого компонента с применением физико-химических методов.
Несколько килограммов растения, собранного в виде урожая на гидропонной установке, передано на дальнейшую переработку.
Известно, что целевое вещество содержится в листьях, стеблях и корнях растений, при этом на переработку переданы полностью сформировавшиеся растения: цветки, листья, стебли, корни, распределенные в пропорции \(1:1:2:2\) соответственно.
Для получения водного раствора целевого вещества необходимо залить водой измельченную массу и выдерживать ее несколько часов при постоянной температуре на водяной бане.
Полученную субстанцию фильтруют, а оставшаяся жидкость становится основным источником целевого полезного вещества для последующей экстракции с применением хлороформа.
- Сколько граммов подготовленного сырья поступает на этап экстракции с помощью органического вещества, если известно, что при промывке и удалении лишних частей растения было удалено 2 кг частей, не содержащих целевое вещество, что полностью включает в себя все нецелевые фрагменты растения, а также 5% от общей массы полезных частей сырья, содержащих целевое вещество?
- Каким может быть коэффициент распределения выделяемого вещества между водной и органической фазой, если их распределение в растворе и экстрагенте равно 0,04 моль/л и 0,06 моль/л соответственно, а в 1 л водного раствора содержится 200 г целевого вещества?
- Сколько этапов последовательной экстракции необходимо провести, если в начале процесса есть 2 л водного раствора и 4 л экстрагента, а после извлечения в исходном растворе должно остаться менее 30% целевого вещества?
В процессе экстракции можно не только выделять полезные вещества для дальнейшего использования, но и наоборот, очищать от примесей определенные смеси, получая конечный продукт высокой чистоты (более 90%).
Этот процесс активно используется при производстве сырья в виде ароматических углеводородов для дальнейшего применения в нефтехимической промышленности.
Одним из наиболее востребованных веществ данного класса является соединение А.
Известно, что часто в качество сырья для его производства используют риформинг-бензин. Но в ходе цепочки превращений его можно получить и из других соединений.
Последовательно проведите следующую цепочку превращений.
- Нагреть метан до температуры более 1500 °C.
- Снизить температуру до 400 °C и добавить активированный уголь.
- Провести реакцию алкилирования с хлорметаном в присутствии хлорида алюминия.
- Получить с участием перманганата калия соль бензойной кислоты.
- Провести реакцию с твердым гидроксидом калия с образованием вещества А.
Запишите все указанные реакции и укажите условия их протекания.
- Известно, что при сгорании соединения А образуется значительное количество копоти. С чем это связано?
- Запишите общую формулу гомологического ряда соединения А. Какое общее короткое название они имеют?
Известно, что целевое вещество содержится в листьях, стеблях и корнях растений, при этом на переработку переданы полностью сформировавшиеся растения: цветки, листья, стебли, корни, распределенные в пропорции \(1:1:2:2\) соответственно.
Было удалено 2 кг частей, не содержащих целевое вещество, что полностью включает в себя все нецелевые фрагменты растения, а также 5% от общей массы полезных частей сырья, содержащих целевое вещество.
Сколько граммов подготовленного сырья поступает на этап экстракции с помощью органического вещества, если известно, что при промывке и удалении лишних частей растения было удалено 5%.
Всего: Х кг.
Удалено — 2 кг, это масса всего, что не содержит полезного вещества.
Пропорция: \(1+1+2+2 = 6\) частей.
Цветки — 1 часть — 2 кг.
Листья — 1 часть — 2 кг.
Стебли — 2 части — 4 кг.
Корни — 2 части — 4 кг.
\(10 \cdot 0{,}95 = 9{,}5\) кг. (1 балл)
Каким может быть коэффициент распределения выделяемого вещества между водной и органической фазой, если их распределение в растворе и экстрагенте равно 0,04 моль/л и 0,06 моль/л соответственно, а в 1 л водного раствора содержится 200 г целевого вещества?
\(K = C_1/C_2 = 0{,}04/0{,}06 = 0{,}667\). (1 балл)
Сколько этапов последовательной экстракции необходимо провести, если на первой ступени процесса есть 2 л водного раствора и 4 л экстрагента, а после извлечения в исходном растворе должно остаться менее 30% целевого вещества?
В 1 л раствора 200 г целевого вещества. То есть \(g_0 = 200\) г.
\(G_1 =g_0(k\cdot V_1/(k\cdot V_1 +V_2))\);
\(G_1 = 200\cdot (0, 667\cdot 2/(0, 667\cdot 2+4)) = 50, 019\) г — осталось в растворе. (1 балл)
В процентном соотношении \(x = (50{,}019 \cdot 100/200) = 25{,}009\%\). (1 балл)
Достаточно 1 этапа. (1 балл)
Последовательно проведите следующую цепочку превращений:
- Нагреть метан до температуры более 1500 °C.
- Снизить температуру до 400 °C и добавить активированный уголь.
- Провести реакцию алкилирования с хлорметаном в присутствии хлорида алюминия.
- Получить с участием перманганата калия соль бензойной кислоты.
- Провести реакцию с твердым гидроксидом калия с образованием вещества А.
Запишите все указанные реакции и укажите условия их протекания.
Условия протекания реакции — температура более 1500 °C.
\[\ce{2CH4 ->[1500 °C] H-C#C-H + 3H2}. ~(\textit{1~балл})\]
Условия протекания реакции — наличие активированного угля, C акт, температура около 400 °C.
\[\ce{3CH # CH -> C6H6}.~ (\textit{1~балл})\]
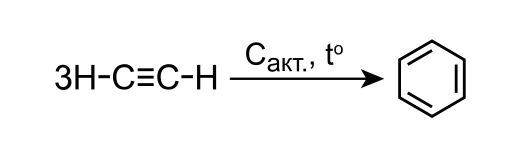 Рис. 2.1.
Рис. 2.1.Условия протекания реакции — высокая температура.
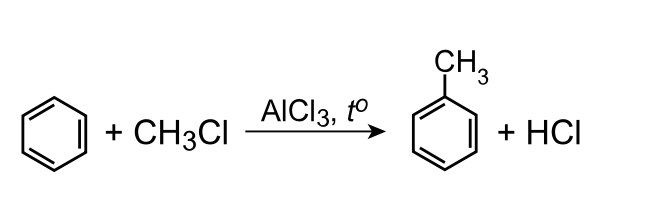
\[\ce{C6H6 + CH3Cl -> C6H5CH3 + HCl}.~ (\textit{1~балл})\]
Рис. 2.2.Условия протекания реакции — высокая температура.
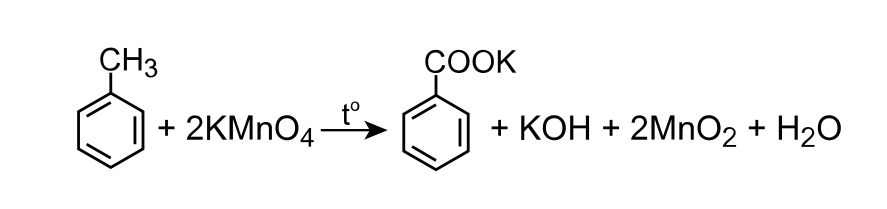
\[\ce{C_6H_5CH_3 +2KMnO_4 -> C_6H_5COOK + KOH +2MnO_2 + H_2O}.~ (\textit{1~балл})\]
Рис. 2.3.Условия протекания реакции — высокая температура.
\[\ce{C_6H_5COOK + KOH -> C_6H_6 + K_2CO_3}~ (\textit{1~балл})\]
или \(\ce{C_6H_5COONa + NaOH -> C_6H_6 + Na_2CO_3}\).
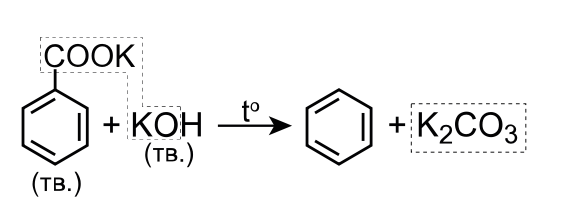 Рис. 2.4.
Рис. 2.4.
При сгорании соединения А образуется значительное количество копоти. С чем это связано?
Бензол содержит около 92% углерода, при неполном его сгорании образуется много копоти. Поднесем к чашке с бензолом горящую лучину. Бензол быстро вспыхивает и горит ярким сильно коптящим пламенем. (1 балл)
Запишите общую формулу гомологического ряда соединения А.
\(\text{C}_n\text{H}_{2n-6}, (n \geqslant 6)\). (1 балл)
Арены. (1 балл)