Предметный тур. Химия. 3 этап
В прошлом, 2024 году, свой юбилей праздновал Институт химической биологии и фундаментальной медицины СО РАН — ему исполнялось 40 лет. Изначально он был создан как Новосибирский институт биоорганической химии СО АН СССР, которым руководил академик Дмитрий Георгиевич Кнорре. Он являлся деканом факультета естественных наук НГУ и был специалистом в области химической кинетики, молекулярной биологии и биоорганической химии. В то время в институте работа велась по трем основным направлениям: расшифровка геномов различных вирусов, создание базы химии нуклеиновых кислот, разработка и создание различных приборов.
Сейчас в лабораториях Института химической биологии и фундаментальной медицины СО РАН проводятся самые разные исследования:
- генодиагностика инфекционных, аутоиммунных и опухолевых заболеваний,
- производство ферментов для биотехнологии и медицинской диагностики,
- синтез олигонуклеотидов, их производных и нуклеозидтрифосфатов,
- создание противораковых препаратов направленного действия.
В институте активно разрабатываются методы синтетической биологии, геномного редактирования, а все лаборатории оснащены передовым оборудованием, с частью которого участники Олимпиады уже успели познакомиться на заключительном этапе.
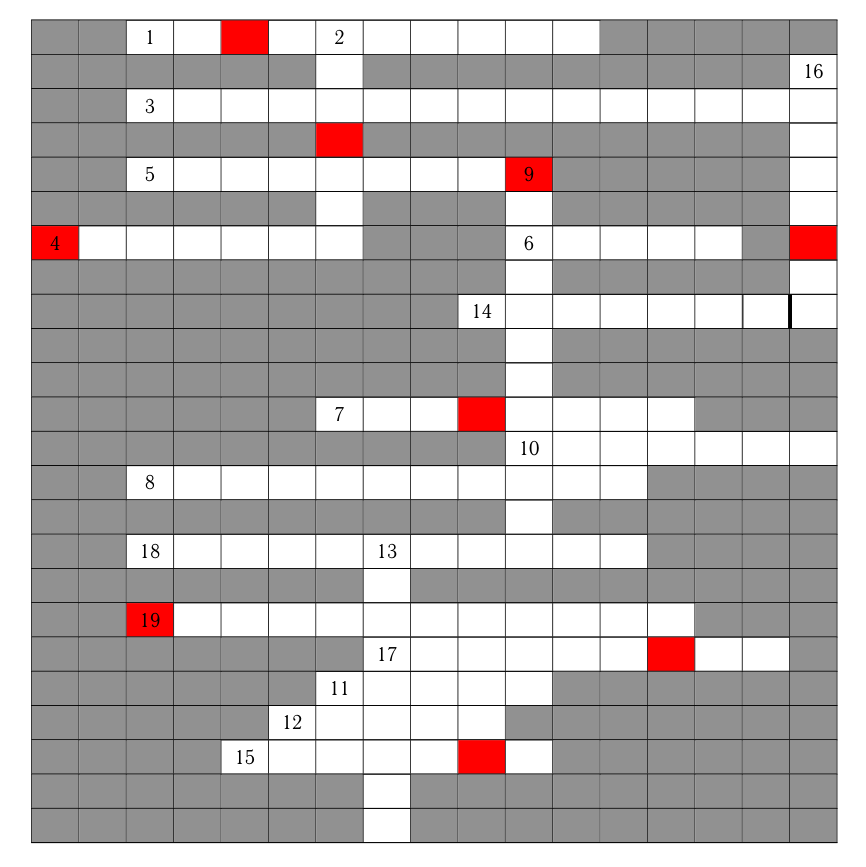
Разгадайте крисс-кросс кроссворд (рис. 1.1), в котором зашифрованы названия различных приборов, химической посуды и реактивов, а также фамилии некоторых ученых, в честь которых названы некоторые предметы. Обратите внимание! Слова 14 и 16 не пересекаются по последней букве.
- Устройство, которое разделяет смеси на фракции с помощью центробежной силы.
- Устройство, перемешивающее вещество в пробирке путем постоянного переворачивания.
- Прибор для определения концентрации раствора путем пропускания света через кювету с раствором исследуемого образца.
- Большое устройство для обеспечения стерильных условий. Необходим, например, для работы с клеточными культурами.
- Горелка для жидкого топлива. В лаборатории используется для проведения качественных реакций при нагревании или стерилизации шпателей для посева клеток.
- Фамилия ассистента Роберта Коха, в честь которого названа посуда, в которой на питательной среде растут клеточные культуры.
- Герметичный аппарат, в котором проводят химические реакции, требующие повышенного давления и температуры.
- Прибор, позволяющий очистить проточную воду от нежелательных примесей методом нагрева и конденсации воды.
- Прибор, позволяющий задавать термоциклические программы. Иногда включает в себя детектор люминесценции для определения ее интенсивности на каждом цикле.
- Линейный полисахарид, образованный из чередующихся остатков \(\beta\)-D-галактопиранозы и 3,6-ангидридо-\(\alpha\)-L-галактопиранозы, объединенных связью 1\(\rightarrow\)4.
- Стеклянная посуда с длинным суженным горлышком для проведения химических реакций.
- Прибор для точного определения массы навески.
- Устройство для поддержания постоянной температуры.
- Приспособление для переноса жидкости точно определенного объема (7 букв).
- Фамилия ученого, который исследовал процесс брожения и сущность разных болезней. В его честь названо пластиковое приспособление для посева клеточных культур.
- Запаянная с одного конца трубка из тонкого стекла для проведения качественных химических реакций.
- Оптический прибор для многократного увеличения образца. Используется, например, для изучения клеток и тканей.
- Прибор, служащий для разделения веществ из смеси на отдельные компоненты за счет разного связывания каждого отдельного вещества сорбентом.
- Метод разделения продуктов реакции по массе путем их движения сквозь поры геля под действием электрического тока.
- Центрифуга.
- Ротатор.
- Спектрофотометр.
- Ламинар.
- Спиртовка.
- Петри.
- Автоклав.
- Дистиллятор.
- Амплификатор.
- Агароза.
- Колба.
- Весы.
- Термостат.
- Пипетка.
- Пастер.
- Пробирка.
- Микроскоп.
- Хроматограф.
- Электрофорез.
Слова 11, 12, 16, 17, 5, 14 — по 1 баллу, остальные по 1,5 балла. Всего 25,5 баллов.
Из выделенных в кроссворде букв сложите слово «Должность студента», низшая должность в лаборатории.
Лаборант — 1,5 балла.
Представьте себе, что вы живете не в XXI веке, а на 7–10 веков раньше. Может быть, вы — рыцарь, и скоро рыцарский турнир, но ваши с противником силы не равны и кажется, что поражения вам не избежать? А может быть, вы — фрейлина при королевском дворе, где враги вашего правителя замышляют заговор против него? Вы понимаете, что тут без хитрости не обойтись!

Простое вещество, образованное элементом X, — редкий активный металл. Препараты его солей широко используются в психиатрии для лечения биполярного аффективного расстройства (БАР) I и II типа, а также в качестве поддерживающей терапии для снижения риска возникновения рецидива.
Ионы данного металла выступают антагонистом ионов натрия в нервных и мышечных клетках. Таким образом они ослабляют проведение нервных импульсов (этим объясняется одно из частых побочных действий препаратов металла X — мышечная слабость). X также влияет на метаболизм и транспорт моноаминов (норадреналина, серотонина), повышает чувствительность некоторых областей мозга к дофамину.
В основе лечения препаратами X биполярных расстройств лежит их свойство относительно селективно ингибировать киназу гликогенсинтазы-3 (GSK-3) путем конкуренции с ионами магния.
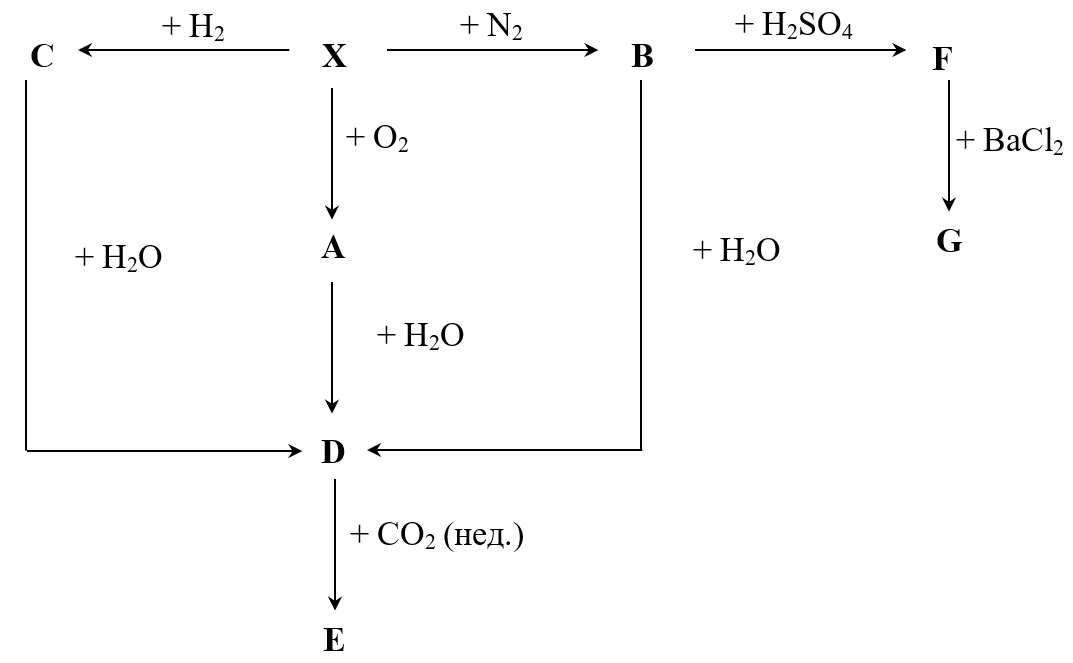
На данной схеме (рис. 1.3) представлены превращения элемента Х и его соединений. Все соединения от А до G содержат X. Соединения E, F, G используются в медицине как действующие вещества в препаратах X для лечения БАР I и II типа.
Соединение А — бинарное, получается при сгорании X в кислороде [1], причем в нем \(\omega(X) = 46{,}5%\) по массе. X также является единственным металлом, который реагирует с азотом воздуха с образованием соединения B [2]. Кроме того, X реагирует с водородом с образованием C [3]. А, В и C гидролизуются (реагируют с водой) с образованием одного и того же продукта D, содержащего X [4, 5, 6].
При добавлении к D углекислого газа (D в избытке) образуется соединение E [7], которое является самым распространенным действующим веществом в препаратах X. При добавлении к B серной кислоты образуется смесь двух средних солей [8], одна из которых — F — содержит X. И наконец, при взаимодействии F с хлоридом бария получается соль G [9].
- Определите элемент X и все его соединения, упомянутые в задаче.
- Назовите соединения A–G.
- Напишите реакции 1–9.
- X — Li (или литий) — 2 балла.
A — Li\(_2\)O, оксид лития. B — Li\(_3\)N, нитрид лития. C — LiH, гидрид лития. D — LiOH, гидроксид лития. E — Li\(_2\)CO\(_3\), карбонат лития. F — Li\(_2\)SO\(_4\), сульфат лития. G — LiCl, хлорид лития.
Верно указано соединение — 1 балл, верно указано название — 1 балл. Всего 14 баллов.
- \(\ce{4Li + O2 -> 2Li2O}\).
- \(\ce{6Li + N2 -> 2Li3N}\).
- \(\ce{2Li + H2 -> 2LiH}\).
- \(\ce{Li2O + H2O -> 2LiOH}\).
- \(\ce{Li3N + 3H2O -> 3LiOH + NH3 ^}\).
- \(\ce{LiH + H2O -> LiOH + H2 ^}\).
- \(\ce{2LiOH + CO2 -> Li2CO3 + H2O}\).
- \(\ce{2Li3N + 4H2SO4 -> 3Li2SO4 + (NH4)2SO4}\).
- \(\ce{Li2SO4 + BaCl2 -> 2LiCl + BaSO4 v}\).
Верно написано уравнение реакции — 1 балл. Всего 9 баллов.
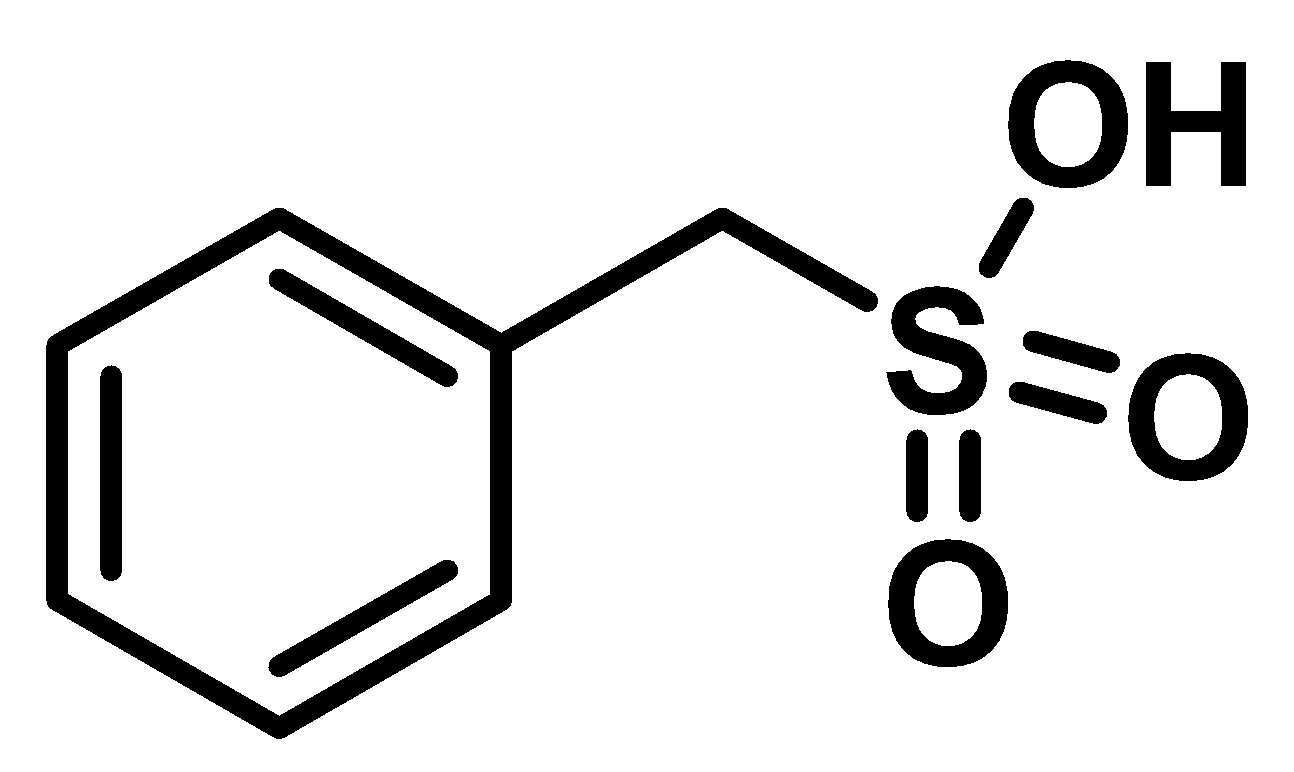
Вещество X — широко используемый ингибитор протеаз и эстераз, имеющий большое значение для биохимических исследований. Его основная функция заключается в ковалентном ингибировании протеаз. При полном сгорании вещества X образуются углекислый газ, серная кислота, плавиковая кислота и вода в соотношении \(7 : 1 : 1 : 2\). Известно, что массовая доля кислорода в соединении составляет 18,4%. Также известно, что в структуре содержится фенильный фрагмент, (\(\ce{C6H5}\) или Ph), присутствует связь \(\ce{C-S}\) и отсутствует связь \(\ce{C-F}\), сера имеет связь с четырьмя атомами, а водород связан только с атомами углерода. При реакции X с водой постепенно образуется смесь двух кислот Y и Z (M\(_z\) > M\(_y\)). Недавно ученые показали, что за счет данной реакции вещество X можно эффективно использовать для реминерализации эмали. В основе лежит реакция гидроксиапатита, \(\ce{Ca5(PO4)3(OH)}\), содержащегося в зубной эмали, с кислотой Y (реакция 1). Также известно, что с растворами Y нельзя работать в стеклянной посуде.
- Определите брутто-формулу вещества X.
- Нарисуйте структурную формулу X. Фенильный фрагмент можно обозначить Ph.
- Определите Y и Z. Для последнего определите структурную формулу (аналогично X).
- Напишите уравнение реакции 1. Объясните, почему с растворами Y нельзя работать в стеклянной посуде, ответ подтвердите уравнением реакции.
Перепишем данное в условии соотношение продуктов как соотношение элементов. Тогда получим, что \[\text{C} : \text{S} : \text{F} : \text{H} = 7 : 1 : 1 : (2\cdot 2 + 2 + 1) = 7 : 1 : 1 : 7.\] Положим, что X — это \(\ce{C7H7SFO_x}\). Найдем \(x\): \[16 \cdot x = (16 \cdot x + 7 \cdot 12 + 19 + 32 + 7) \cdot 0{,}184=2.\] Решая уравнение, находим \(x = 2\).
Итого: подходит брутто-формула \(\ce{C7H7SFO2}\).
5 баллов за верную брутто-формулу.
Вычтем из брутто-формулы X структурный фрагмент \(\ce{C6H5}\). Получим \(\ce{CH2SFO2}\). Нет связи \(\ce{C-F}\), но есть связь \(\ce{C-S}\), следовательно, имеется связь \(\ce{S-F}\) и фрагмент \(\ce{C-S-F}\). Осталось расставить два атома кислорода и водорода. С учетом всех уточняющих данных единственным способом будет разместить их следующим образом: \(\ce{CH2-SO2-F}\). Недостающий фрагмент определен. Таким образом, структура X: \(\ce{Ph-CH2-SO2-F}\).
5 баллов за верную структуру X.
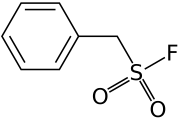 Рис. 1.5.
Рис. 1.5.Y — HF.
6 баллов (по 3 за каждое вещество).
Рис. 1.6.- \[\ce{Ca5(PO4)3(OH) + HF = Ca5(PO4)3F + H2O}.\] Нельзя работать, т. к. HF растворяет стекло по реакции: \[\ce{SiO2 + 6HF = H2[SiF6] + 2H2O}.\] По 2 балла за каждую реакцию, 1 балл за ответ на вопрос. Всего 5 баллов.
«...твой шепот нежный-нежный разгонит грусть!»
КВН, команда «ДАЛС»
Углеводы — органические вещества, которые содержат карбонильную группу и несколько гидроксильных групп. Эти соединения получаются только в процессе фотосинтеза, но тем не менее они являются неотъемлемым компонентом клеток и тканей всех живых организмов, имеют разное строение и выполняют разные функции.
Углеводы делятся на несколько классов в зависимости от количества мономеров в своем составе: углеводы, содержащие одну единицу, называются моносахариды, две единицы — дисахариды, от трех до десяти единиц — олигосахариды, а более десяти — полисахариды. Другое название, которое используется для объединения низкомолекулярных углеводов, — сахара.
Одним из самых распространенных в природе дисахаридов является сахароза. Она встречается во многих фруктах, плодах и ягодах. Особенно велико содержание сахарозы в сахарной свекле и сахарном тростнике, из сока которых ее экстрагируют и очищают на сахарных заводах. После прохождения многих стадий обработки из чистой сахарозы получается сахар, который используется в производстве продуктов питания.
Определите брутто-формулу сахарозы, если общая формула углеводов \(\ce{C_x(H2O)_y}\), углерода в 0,545 раз меньше, чем водорода. Небольшая подсказка! Воспользуйтесь справочными данными.
Из условия \(x = 2\cdot 0{,}545\cdot y\). Тогда, чтобы получить молярную массу, необходимо составить уравнение: \(12\cdot 0{,}545\cdot 2y+18y=342\). Находя из уравнения \(y = 11\), подставляем в исходное и получим \(x = 12\). Соответственно, брутто-формула сахарозы: \(\ce{C12(H2O)11}\).
Определите коэффициенты в уравнении сгорания сахарозы. По уравнению сгорания при 186 °C рассчитайте изменение энтальпии и энтропии в реакции. Небольшая подсказка! Воспользуйтесь справочными данными.
Уравнение сгорания сахарозы (без коэффициентов): \[\text{Сахароза} + \ce{O2 -> CO2 + H2O}.\]
Уравнение сгорания:
\[\ce{C12H22O11 + 12 O2 -> 12 CO2 + 11 H2O}.\]
За верно расставленные коэффициенты — 2 балла.
Для решения необходимо принять, что энтальпия и энтропия реакции не зависят от температуры. Эти параметры вычисляются, исходя из разницы в начальном и конечном состоянии реакции. \[\Delta_r H° = -241{,}82\cdot 11-393{,}51\cdot 12+2226{,}1 = -5156{,04} \text{ кДж/моль};\] \[\Delta_r S° =188{,}72\cdot 11+213{,}67\cdot 12-12\cdot 205{,}04-360{,}24 = 1819{,24} \text{ Дж/моль}\cdot \text{К}.\] За расчет каждого параметра по 4 балла. Всего 8 баллов.
Исходя из полученных значений, определите значение изменения энергии Гиббса для данной реакции и на основании этого сделайте вывод о направлении протекания данной реакции.
186 °C = 459 К. Энергия Гиббса вычисляется по формуле: \[\Delta_r G° =\Delta_r H° - T\cdot \Delta_r S°.\]
Полученное после подстановки в уравнение значений энтальпии и энтропии из задания 2 значение \(\Delta_r G° = -5991{,07}\) кДж/моль.
Напишите, какие мономеры входят в состав сахарозы. В каких еще углеводах встречаются эти мономеры? Приведите по два примера.
В состав сахарозы входят глюкоза и фруктоза — по 2 балла за название. Примеры соединений, в которые входит глюкоза: целлюлоза, крахмал, гликоген, мальтоза, лактоза и т. д. Примеры соединений, в которые входит фруктоза: рафиноза, инулин и т. д.
За каждый верный пример — 1,5 балла, всего 6 баллов. За каждый неверный пример — \(- 1\) балл, но в сумме не меньше 0.
Молярная масса сахарозы — 342 г/моль, 0 °C = 273 К.
| Вещество | \(\Delta_f H^\circ_{298}\), кДж/моль | \(\Delta_f S^\circ_{298}\), Дж/моль·К |
|---|---|---|
| \(\ce{H_2O}\)\(_{(\text{г}.)}\) | \(-241{,}82\) | \(188{,}72\) |
| \(\ce{CO_2}\) | \(-393{,}51\) | \(213{,}67\) |
| \(\ce{O_2}\) | \(-\) | \(205{,}04\) |
| Сахароза | \(-2226{,}1\) | \(360{,}24\) |
В прошлом, 2024 году, свой юбилей праздновал Институт химической биологии и фундаментальной медицины СО РАН — ему исполнялось 40 лет. Изначально он был создан как Новосибирский институт биоорганической химии СО АН СССР, которым руководил академик Дмитрий Георгиевич Кнорре. Д. Г. Кнорре возглавлял факультет естественных наук НГУ и был специалистом в области химической кинетики, молекулярной биологии и биоорганической химии. В то время в институте работа велась по трем основным направлениям: расшифровка геномов различных вирусов, создание базы химии нуклеиновых кислот, разработка и создание различных приборов.
Сейчас в лабораториях Института химической биологии и фундаментальной медицины СО РАН занимаются самыми разными исследованиями:
- генодиагностикой инфекционных, аутоиммунных и опухолевых заболеваний,
- производством ферментов для биотехнологии и медицинской диагностики,
- синтезом олигонуклеотидов, их производных и нуклеозидтрифосфатов,
- созданием противораковых препаратов направленного действия.
В институте активно разрабатываются методы синтетической биологии, геномного редактирования, а все лаборатории оснащены передовым оборудованием. С некоторыми из них участники Олимпиады уже успели познакомиться на заключительном этапе.
- Центрифуга.
- Ротатор.
- Спектрофотометр.
- Ламинар.
- Спиртовка.
- Петри.
- Автоклав.
- Инкубатор.
- Амплификатор.
- Агароза.
- Колба.
- Весы.
- Термостат.
- Пипетка.
- Пастер.
- Пробирка.
- Микроскоп.
- Хроматограф.
- Электрофорез.
- Буфер.
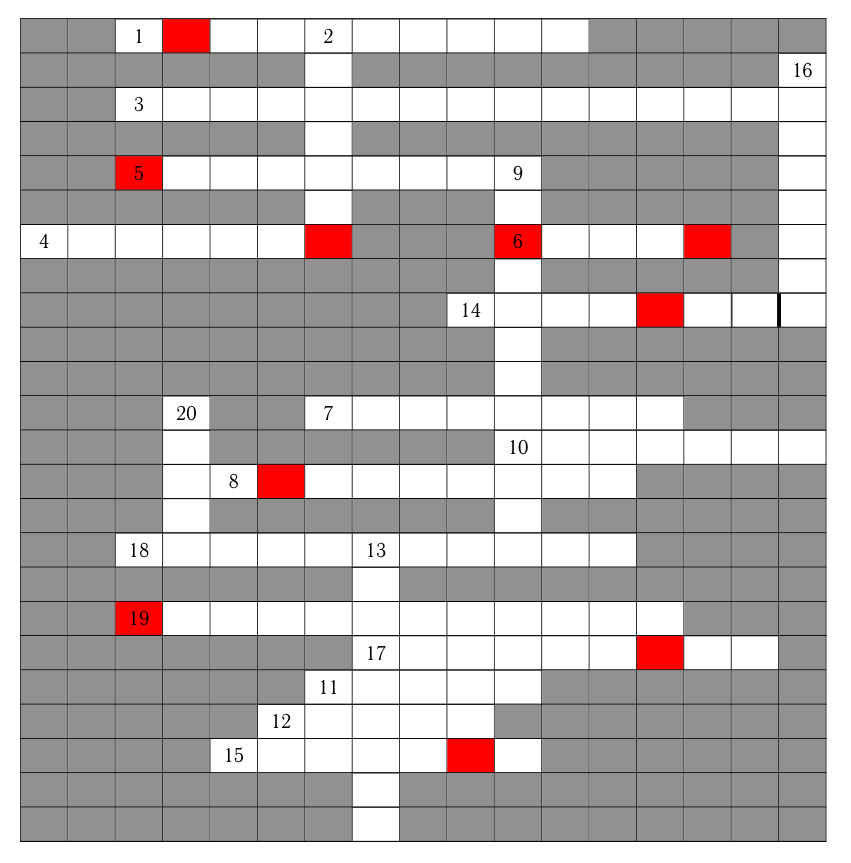
По 1 баллу за каждое верно угаданное слово.
Из выделенных в кроссворде букв сложите слово — то, что сотрудники института делают в рамках исследования для того, чтобы определить наиболее благоприятные условия протекания реакций.
Эксперимент.
Представьте себе, что вы живете не в XXI веке, а на 7–10 веков раньше. Может быть, вы — рыцарь, и скоро рыцарский турнир, но ваши с противником силы не равны и кажется, что поражения вам не избежать? А может быть, вы — фрейлина при королевском дворе, где враги вашего правителя замышляют заговор против него? Вы понимаете, что тут без хитрости не обойтись!

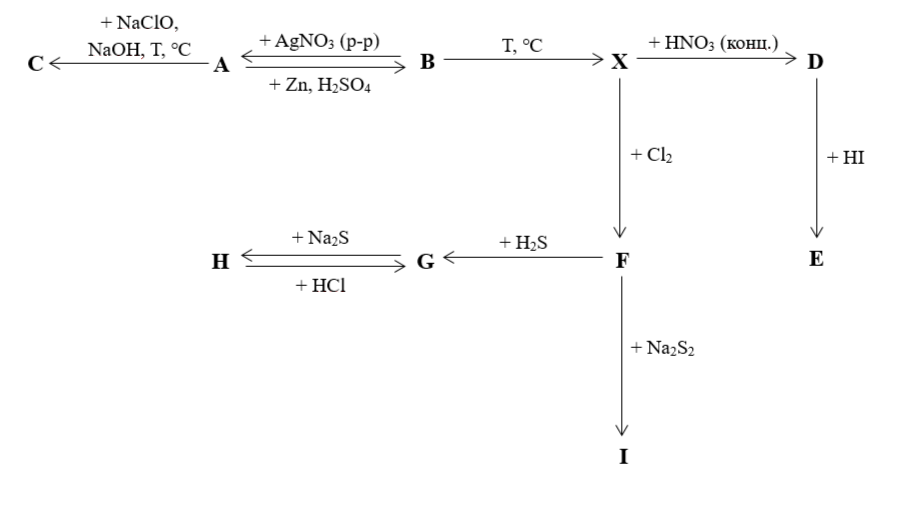
Соединения элемента Х с глубокой древности использовались в качестве ядов. Его токсическое действие проявляется в блокаде пируватдегидрогеназного комплекса, что приводит к гипогликемии. Кроме того, соединения элемента X значительно снижают активность ферментов, участвующих в синтезе глутатиона (глутатионсинтетаза, глутатионредуктаза), вследствие чего возникает дефицит глутатиона в печени и ухудшаются процессы детоксикации соединений X.
На схеме (рис. 2.3) приведены превращения элемента X и его соединений. Все соединения A–I содержат X. Наиболее устойчивой формой Х является оксид A, причем \(\omega(X) = 75{,}75%\) по массе. Для выделения X из A, чтобы, например, доказать наличие яда в продуктах питания, используется следующая методика: пробу помещают в серную кислоту с добавлением нескольких гранул цинка. В результате протекающей химической реакции выделяется газ B [1], который при нагревании разлагается на два простых вещества — X и H\(_2\) [2]. Газ B является сильным восстановителем: восстанавливает серебро из раствора его нитрата, превращаясь при этом обратно в A [3].
В оксиде A элемент X находится в промежуточной степени окисления. Его можно доокислить до высшей, если твердофазно нагреть А с едким натром и гипохлоритом натрия, при этом получится соль C [4]. Если же добавить к X концентрированную азотную кислоту, то можно получить кислоту D, содержащую X в высшей степени окисления, в ходе реакции выделяется бурый газ [5]. При взаимодействии с HI проявляются окислительные свойства кислоты D, образуются кислота E и простое вещество [6].
X может взаимодействовать с галогенами с получением соответствующих галогенидов [7]. Галогениды X, в свою очередь, взаимодействуют с различными серосодержащими соединениями. Например, при реакции F с сероводородом выпадает желтый осадок сульфида X [8], который не растворяется в кислотах, но может быть растворен в избытке сульфида натрия с образованием H [9]. Если к H добавить соляную кислоту, снова выделяется сульфид G [10]. Галогенид F сразу может быть растворен в дисульфиде натрия с образованием I, причем протекает окислительно-восстановительная реакция [11].
- Определите элемент X.
- Расшифруйте схему превращений, дайте названия соединениям B – E, H.
- Напишите реакции [1]–[11], упомянутые в условии задачи.
- X — As (или «мышьяк») — 1 балл.
A — \(\ce{As2O3}\).
B — \(\ce{AsH3}\), арсин.
C — \(\ce{Na3AsO4}\), ортоарсенат натрия.
D — \(\ce{H3AsO4}\), мышьяковая кислота.
E — \(\ce{H3AsO3}\), мышьяковистая кислота.
F — \(\ce{AsCl3}\).
G — \(\ce{As2S3}\).
H — \(\ce{Na3AsS3}\), тритиоарсенит натрия.
I — \(\ce{Na3AsS5}\).
Верно указано соединение — 1 балл, верно указано название — 1 балл.
- \(\ce{As2O3 + 6Zn + 6H2SO4 -> 6ZnSO4 + 2AsH3^ + 3H2O}\).
- \(\ce{2AsH3 -> 2As + 3H2^}\).
- \(\ce{2AsH3 + 12AgNO3 + 3H2O -> As2O3 + 12Ag + 12HNO3}\).
- \(\ce{As2O3 + 2NaClO + 6NaOH -> 2Na3AsO4 + 2NaCl + 3H2O}\).
- \(\ce{As} + \ce{5HNO}_{3_\text{конц.}}\)\(\ce{ -> H3AsO4 + 5NO2^ + H2O}\).
- \(\ce{H3AsO4 + 2HI -> H3AsO3 + I2 v + H2O}\).
- \(\ce{2As + 3Cl2 -> 2AsCl3}\).
- \(\ce{2AsCl3 + 3H2S -> As2S3 v + 6HCl}\).
- \(\ce{As2S3 + 3Na2S -> 2Na3AsS3}\).
- \(\ce{2Na3AsS3 + 6HCl -> As2S3 v + 3H2S^ + 6NaCl}\).
- \(\ce{AsCl3 + 3Na2S2 -> Na3AsS4 + 2S + 3NaCl}\).
В решениях приведены орто-формы (кислоты, соли, тиосоли), мета-формы тоже считаются верным ответом.
Верно написано уравнение реакции — 1 балл.
В 2022 году Нобелевскую премию по химии вручили Барри Шарплессу, Каролин Р. Бертоззи и Мортену Мелдалю за создание и развитие клик-химии и биортогональной химии. Клик-химия — это универсальный синтетический подход, позволяющий эффективно проводить химические превращения. Клик-реакции характеризуются:
- около количественным выходом,
- универсальностью превращения,
- высокой селективностью,
- мягкими условиями,
- низкой чувствительностью к воздуху, влаге, параметрам растворителя,
- относительно высокой скоростью превращения.

Благодаря этому клик-химия находит множество приложений в фармацевтической отрасли: она позволяет осуществлять быстрый синтез библиотек соединений, а также «сшивать» разные функциональные фрагменты друг с другом и с биомолекулами. Некоторые клик-реакции также являются биортогональными — то есть могут протекать в биологических условиях.
Одной из первых и наиболее часто используемых реакций является азид-алкиновое циклоприсоединение (AAC, R-N\(_3\) — азидный фрагмент). В результате реакции образуется азотсодержащий пятичленный ароматический гетероцикл. Существует несколько распространенных разновидностей AAC: медь-катализуемое CuAAC, рутений-катализируемое RuAAC, а также вызванное напряженностью в цикле SPAAC (Strain Promoted). SPAAC отличается отсутствием необходимости в использовании катализаторов, в то время как для RuAAC и CuAAC характерна селективная реакция как правило, в RuAAC преимущественно образуется 1,5 изомер, а в CuAAC образуется 1,4 изомер. Кроме того, RuAAC, в отличие от CuAAC, не ограничен терминальными алкинами.
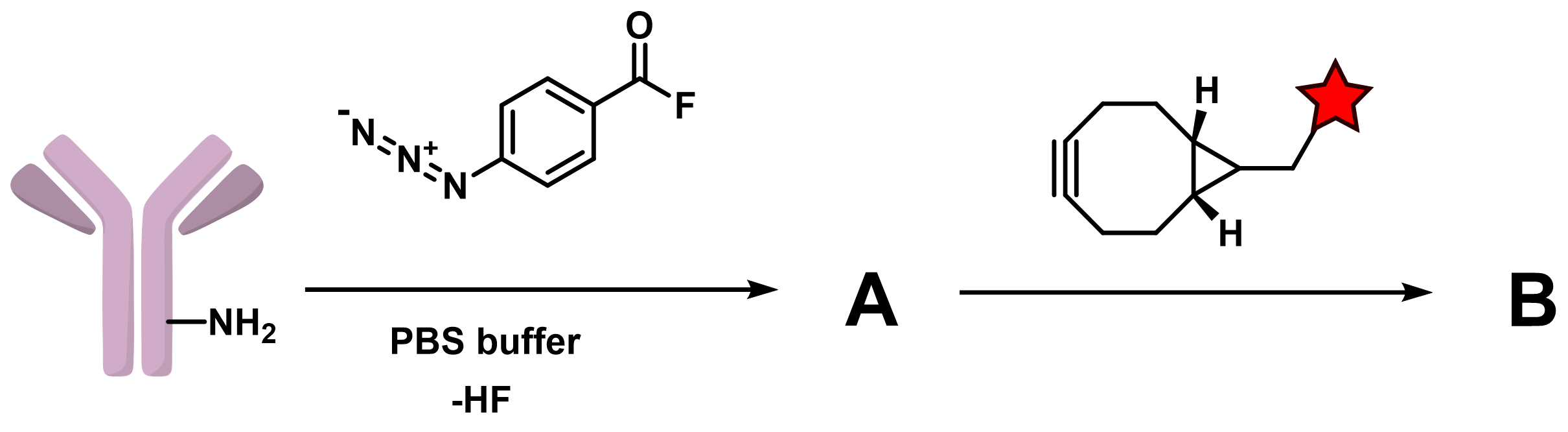
К примеру, SPAAC может быть использован для функционализации антител. Азидный фрагмент вводится лизин-специфичной реакцией п-азидобензоил фторида с антителом, причем степень конъюгации может регулироваться. Далее следует SPAAC, с помощью которого вводится функциональный фрагмент. Это может быть лекарственный фрагмент, токсин, олигонуклеотид, флуоресцентная метка.
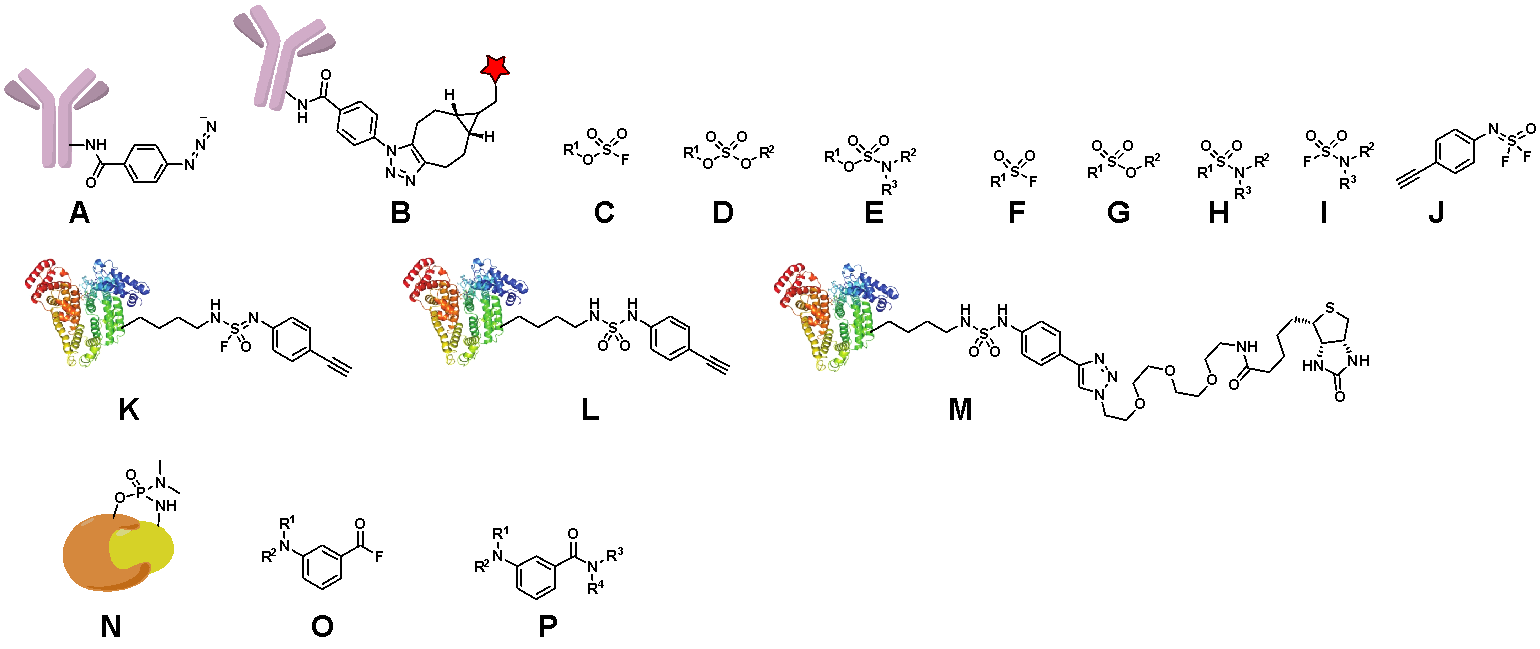
Химия SuFEx (Сера (VI) Фторидный Обмен) — это универсальная и эффективная синтетическая методология, получившая широкое распространение с момента ее разработки Барри Шарплессом в 2014 году. В основе метода лежит реакция сера-центрированных электрофилов, содержащих S-F связь, с различными нуклеофилами.
На рис. 2.6 представлены общие подходы SuFEx и пример синтеза конъюгата бычьего сывороточного альбумина с биотином. Известно, что в соединении L присутствуют две связи S=O. Совсем недавно в соавторстве с Барри Шарплессом был разработан аналог реакций SuFEx, Фосфор (V) Фторидный Обмен (PFEx), использующий более стабильные в биологических условиях производные фосфора. Данный подход уже был успешно применен для ковалентной сшивки взаимодействующих белков (рис. 2.6).
Альтернативным подходом является photo-DAFEx. Данный метод заключается в фотохимической генерации промежуточного продукта O, способного вступать во фторидный обмен, из инертного трифторметильного производного в результате фотохимического гидролиза. Известно, что продукт (соединение О) содержит фрагмент двойной связи C=O.
Приведите структуры A – L.
Небольшая подсказка! Фрагмент антитела в структуре B предлагается обозначить буквой Y, фрагмент белка в структурах K, L, M значком окружности (\(\circ\)). В структуре N фрагменты белков взаимодействуют, что необходимо проиллюстрировать в ответе (данную структуру рекомендуется рисовать приближенно к тому, как нарисованы реагенты).
Предположите механизм действия противоопухолевых биоконъюгатов токсин-антитело (функцию токсина и антитела).
Антитело необходимо для селективной доставки в опухолевые клетки (за счет связывания с антигеном на поверхности опухолевой клетки), токсин — для уничтожения опухолевых клеток. Принимаются любые близкие по смыслу ответы (2 балла).
«...твой шепот нежный-нежный разгонит грусть!»
КВН, команда «ДАЛС»
Углеводы — органические вещества, которые содержат карбонильную группу и несколько гидроксильных групп. Эти соединения получаются только в процессе фотосинтеза, но тем не менее они являются неотъемлемым компонентом клеток и тканей всех живых организмов, бывают разного строения и выполняют разные функции.
Углеводы делятся на несколько классов в зависимости от количества мономеров в своем составе: углеводы, содержащие одну единицу, называются моносахариды, две единицы — дисахариды, от трех до десяти единиц — олигосахариды, а более десяти — полисахариды. Другое название, которое используется для объединения низкомолекулярных углеводов, — сахара.
Одним из самых распространенных в природе дисахаридов является сахароза. Она встречается во многих фруктах, плодах и ягодах. Особенно велико содержание сахарозы в сахарной свекле и сахарном тростнике, из сока которых ее экстрагируют и очищают на сахарных заводах. После прохождения многих стадий обработки из чистой сахарозы получается сахар, который используется в производстве продуктов питания.
Напишите уравнение сгорания сахарозы и определите ее брутто-формулу, если общая формула углеводов C\(_x\)(H\(_2\)O)\(_y\), углерода в 0,545 раз меньше, чем водорода.
Подсказка: воспользуйтесь справочными данными.
Из условия \(x = 2\cdot 0{,}545\cdot y\). Тогда, чтобы получить молярную массу, необходимо составить уравнение: \(12\cdot 0{,}545\cdot 2y+18y=342\). Находя из уравнения \(y = 11\), подставляем в исходное и получим \(x = 12\). Соответственно, брутто-формула сахарозы: \(\ce{C12(H2O)11}\) (3 балла).
Уравнение сгорания сахарозы: \(\ce{C12H22O11 + 12 O2 -> 12 CO2 + 11 H2O}\) (3 балла).
По уравнению сгорания сахарозы при 186 °C рассчитайте изменение энтальпии и энтропии в реакции.
Подсказка: воспользуйтесь справочными данными.
Для решения необходимо принять, что энтальпия и энтропия реакции не зависят от температуры. Эти параметры вычисляются, исходя из разницы в начальном и конечном состоянии реакции.
\[\Delta_r H° = -241{,}82\cdot 11-393{,}51\cdot 12+2226{,}1 = -5156{,04} \text{ кДж/моль};\] \[\Delta_r S° =188{,}72\cdot 11+213{,}67\cdot 12-12\cdot 205{,}04-360{,}24 = 1819{,24} \text{ Дж/моль}\cdot \text{К}.\] По 4 балла за каждый расчет. Всего 8 баллов.
Исходя из полученных значений, определите значение изменения энергии Гиббса для данной реакции и на основании этого сделайте вывод о направлении протекания данной реакции.
186 °C = 459 К. Энергия Гиббса вычисляется по формуле: \[\Delta_r G° =\Delta_r H° - T\cdot \Delta_r S°.\]
Полученное после подстановки в уравнение значений энтальпии и энтропии из задания 2 значение \(\Delta_r G° = -156040 -459\cdot 1819{,24}= -5991{,07}\) кДж/моль.
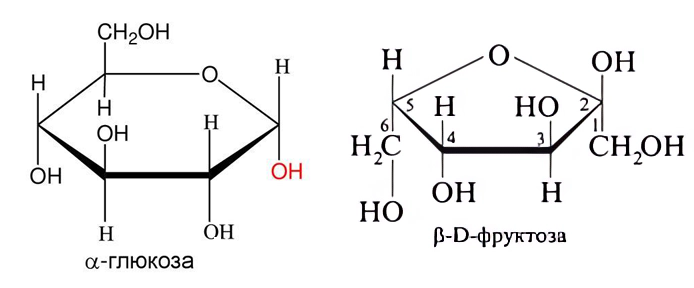
Напишите, какие мономеры входят в состав сахарозы, нарисуйте их строение в циклической форме. Какая связь между ними образуется?
В состав сахарозы входят \(\alpha\)-глюкоза и \(\beta\)-D-фруктоза — по 1 баллу за название, 0,5, если не указан изомер \(\alpha\) или \(\beta\).
Именно в таких формах мономеры входят в состав сахарозы — по 2 балла за каждую структуру. Между ними образуется гликозидная связь (эфирная также является правильным ответом) — 1 балл за название связи.
Молярная масса сахарозы — 342 г/моль, 0 °C = 273 К.
| Вещество | \(\Delta_f H^\circ_{298}\), кДж/моль | \(\Delta_f S^\circ_{298}\), Дж/моль·К |
|---|---|---|
| \(\ce{H_2O}\)\(_{(\text{г}.)}\) | \(-241{,}82\) | \(188{,}72\) |
| \(\ce{CO_2}\) | \(-393{,}51\) | \(213{,}67\) |
| \(\ce{O_2}\) | \(-\) | \(205{,}04\) |
| Сахароза | \(-2226{,}1\) | \(360{,}24\) |