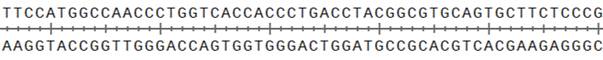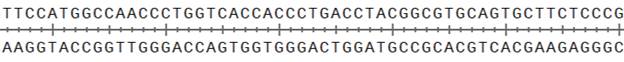Инженерный тур. 3 этап
Задача финала посвящена изменению последовательности гена GFP в бактерии E. coli штамма BL21 при помощи ПЦР-мутагенеза.
Для изменения последовательности гена применяются различные технологии управления свойствами биологических объектов. В данной задаче использован метод мутагенеза с применением ПЦР и мутантных праймеров.
Количество участников в команде: 3 человека.
Компетенции, которыми должны обладать члены команды:
- биоинформатик — 1 участник;
- младшие научные сотрудники молекулярно-биологической лаборатории (2–3 участника).
Для работы в лаборатории используется оборудование:
- автоматические дозаторы,
- центрифуги,
- ПЦР-амплификатор,
- термостат,
- система гель-документации.
Биоинформатики используют программное обеспечение: Python (Anaconda), базы данных NCBI, UGENE, MEGA и другие.
Оборудование и реагенты:
- плазмида pQE30-GFP (концентрация 10 нг/мкл);
- 2Х ПЦР-смесь Mastermix Pfu-Sso7d, 12,5 мкл (пробирка 0,2 мл);
- праймеры
ForиRev(прямой и обратный) для плазмиды pQE30-GFP, по 5 мкл, 2 мкМ (2 пробирки 0,6 мл); - milliQ, деионизованная вода;
- амплификатор;
- автоматические дозаторы объемом 1–10 мкл;
- наконечники для дозатора 10 мкл.
Протокол ПЦР:
- Приготовьте реакционную смесь для ПЦР в пробирке объемом 0,2 мл.
- Подпишите пробирку опознавательными знаками своей команды (для этого добавьте следующие компоненты в пробирку с 12,5 мкл 2Х Mastermix Pfu-Sso7d (пробирка 200 мкл)): по 2,5 мкл 2 мкМ прямого (пробирка F) и обратного праймеров и ___ мкл воды mQ (суммарный объем реакционной смеси — 25 мкл).
- В реакционную смесь внесите 1 мкл раствора плазмиды pQE30-GFP (пробирка ПЛ) и ресуспендируйте пипетированием в пробирке.
- Поместите полученную реакционную смесь для ПЦР в амплификатор.
| Число циклов | Этап | Температура, °C | Время, с |
|---|---|---|---|
| 1 | Денатурация | 98 | 30 |
| 25 | Денатурация | 98 | 10 |
| Отжиг праймеров | 68 | 20 | |
| Элонгация | 72 | 180 | |
| 1 | Элонгация | 72 | 120 |
Электрофорез в агарозном геле:
- Агароза; буфер 1\(\times\)TAE; бромистый этидий.
- Маркер электрофоретической подвижности Sky-High (Биолабмикс).
- 4Х краситель для нанесения ДНК (Биолабмикс).
- Камера для проведения электрофореза; трансиллюминатор или гель-док.
- Автоматические дозаторы объемом 1–10 мкл.
- Наконечники для дозатора 10 мкл.
Протокол агарозного электрофореза:
- Для приготовления 1%-го геля прилейте к навеске агарозы массой 1 г 100 мл 1\(\times\)TAE, доведите до кипения и растворите всю навеску при перемешивании. После остывания раствора агарозы до 50 °C добавьте 5 мкл бромистого этидия (10 мг/мл), перемешайте и перелейте раствор в форму для заливки геля.
- В пробирку на 0,6 мкл внесите 6 мкл ПЦР-продукта из пробирки
mut. Внимание! Оставшийся ПЦР-продуктmut(\(\sim\)19 мкл) передайте организаторам, он будет необходим для дальнейшей работы. К 6 мкл отобранного образца добавьте ___ мкл 4Х буфера для нанесения и перемешайте пипетированием. - Нанесите на агарозный гель 6 мкл подготовленного образца, смешанного с краской.
- Нанесите на агарозный гель 2 мкл маркера длин ДНК.
- Проведите электрофорез в следующих условиях: 120 В, 45 мин.
- Получите изображения геля после электрофореза.
Ежедневно клетки подвергаются действию широкого спектра мутагенных веществ, негативный эффект которых может сказаться на целостности генетической информации в результате повреждения молекул ДНК.
Термин «мутация» был впервые предложен Голландским ботаником Хуго Де Фризом, и в первостепенной своей значимости означает стойкое изменение генотипа клетки. Мутации в клетках могут быть результатом как внутреннего (эндогенного) воздействия, так и внешнего (экзогенного). Примером эндогенного влияния может послужить формирование неканонической пары во время репликации или репарации ДНК. Пример экзогенного — это воздействие радиации или ультрафиолета на молекулу ДНК. В клетках существует система репарации ДНК, направленная на исправление «ошибок» в геноме.
Ученые искусственно вводят мутации в ДНК для того, чтобы изменить последовательность, которая кодирует белок. Сайт-направленный мутагенез — один из способов введения мутации, осуществляемый с помощью полимеразной цепной реакции (ПЦР). Его суть заключается в том, что один из праймеров не полностью комплементарен участку ДНК, вследствие чего продуктом ПЦР будет не исходная матричная ДНК, а ее мутантная копия.
Задание 1. Какое строение имеет молекула ДНК? Какие особенности строения молекулы ДНК обеспечивают наработку продуктов ПЦР? (2 балла)
Ответ: двойная спираль; антипараллельность, комплементарность.
Задание 2. Какие существуют мутации по типу изменения генетического материала? К каким последствиям они приводят? (1 балл)
Ответ: синонимичные и изменяющие тип аминокислоты, делеции, дупликации, инсерции.
Задание 3. Объясните, почему мутация со сдвигом рамки считывания несет самые тяжелые последствия для организма? (1 балл)
Ответ: изменяются, кодоны, аминокислотная последовательность, возникают стоп-кодоны.
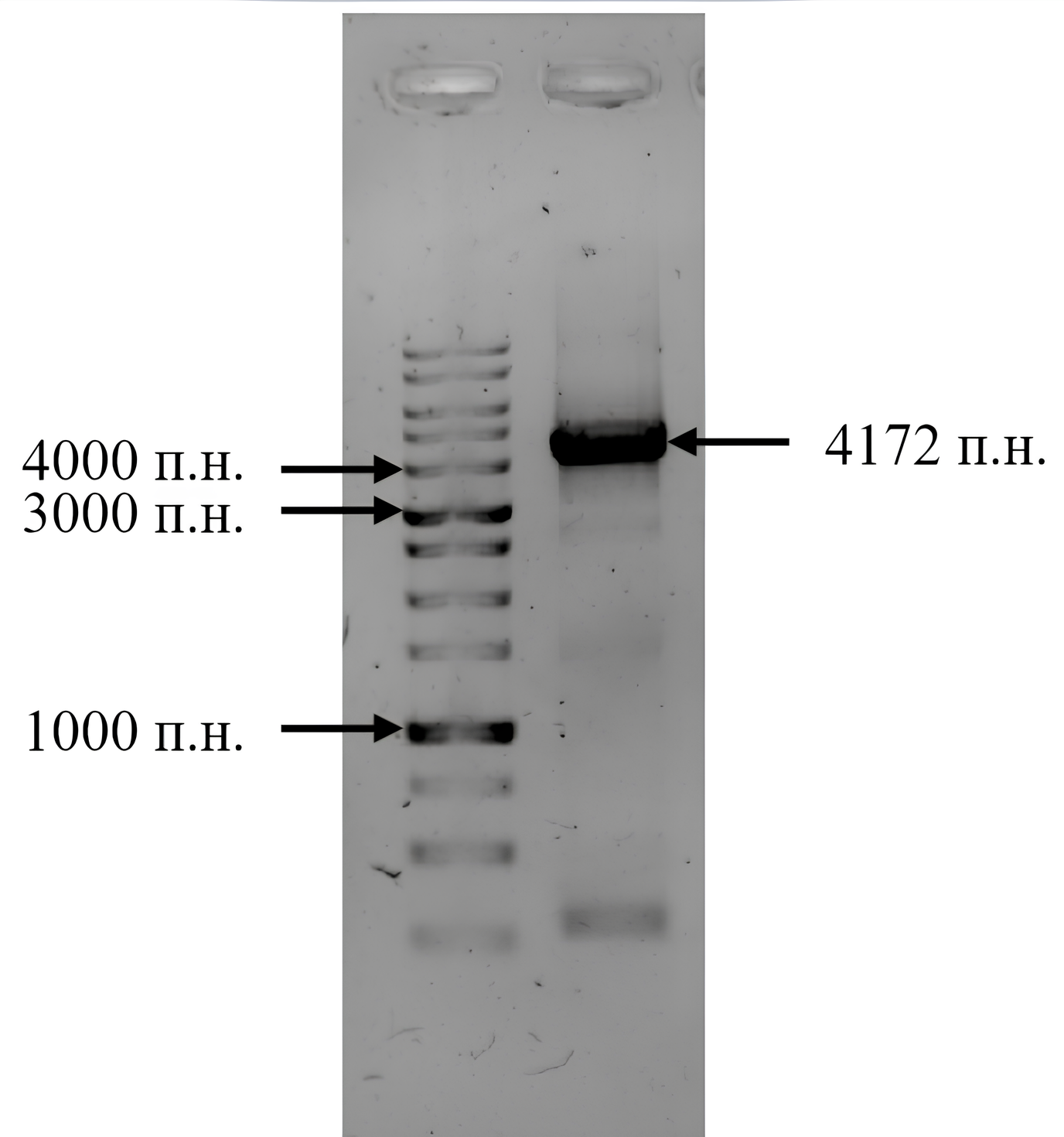
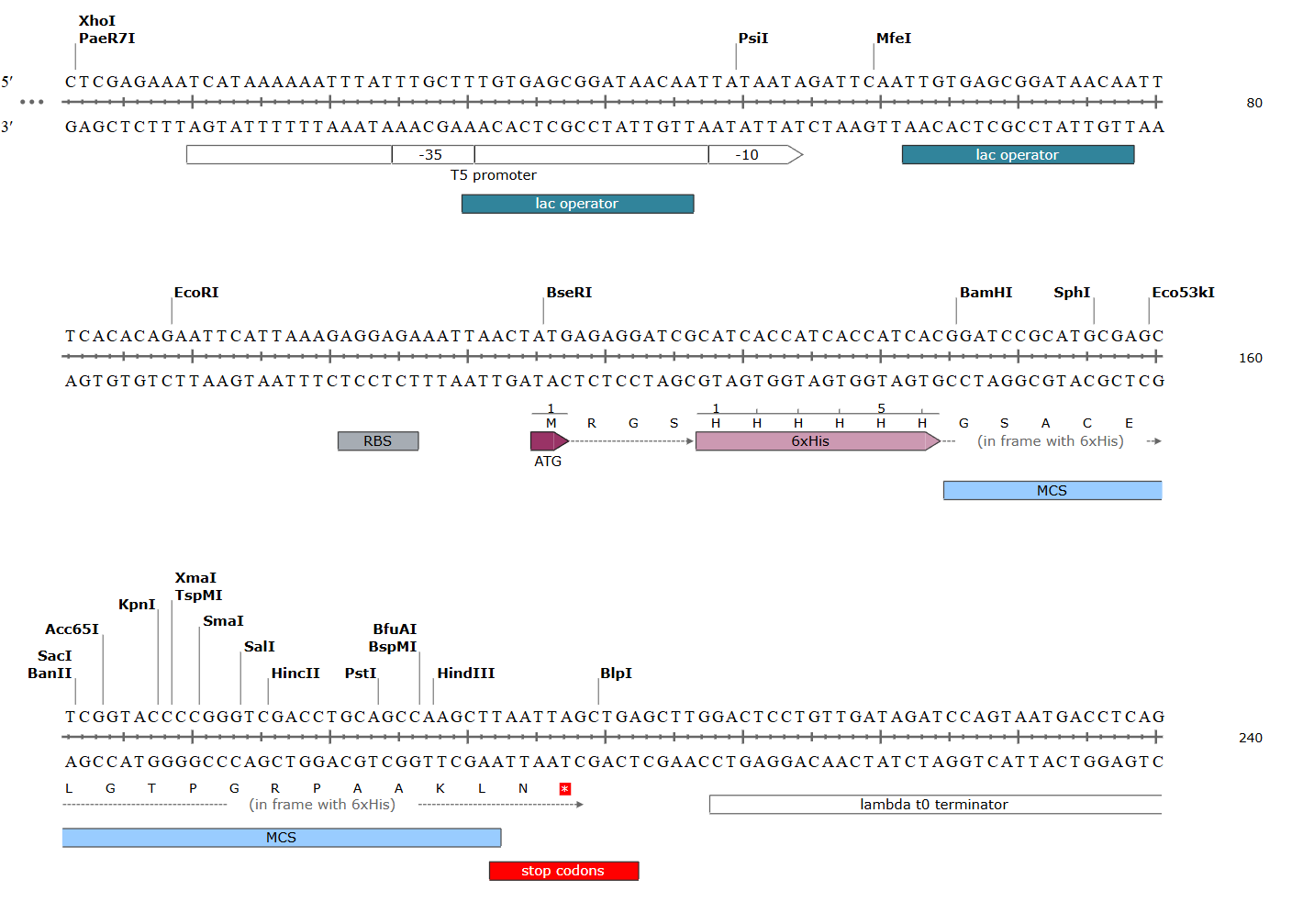
Во время эксперимента мутацию вносили в плазмиду pQE30-GFP, которая содержит в себе последовательность, кодирующую белок GFP. На рис. 5.2 приведена часть последовательности этой плазмиды (верхняя цепь — в направлении \(5^\prime\)-\(3^\prime\)).
Для ПЦР использованы следующие праймеры:
Q5_BFP_For \(5^\prime\)-CACCCTGACCCATGGCGTGCAGT-\(3^\prime\),
Q5_XFP_Rev \(5^\prime\)-GTGACCAGGGTTGGCCATG-\(3^\prime\)
(For — прямой праймер, Rev — обратный).
Задание 4. Рассчитайте в процентах GC-состав праймеров. Исходя из количества водородных связей, которые образуются между праймером и ДНК, оцените, какой из них должен иметь большую температуру отжига. (1 балл)
Ответ: For — 61 водородная связь, GC состав 73%. Rev — 50 водородных связей, GC состав 72%. У прямого праймера выше температура плавления.
Задание 5. На рисунке укажите места отжига праймеров. Какой из них отвечает за появление мутации в итоговом ПЦР продукте? В каком месте происходит мутация, к какому типу она относится? (2 балла)
Ответ: мутация в прямом праймере.
Задание 6. Как изменится состав пептида, который будет получен после синтеза с ПЦР-продукта, по сравнению с пептидом, синтезированным с исходной последовательности? (1 балл)
Ответ: произойдет замена, связанная с изменением кодонов (в прямом праймере).
| Первое основание | Второе основание | Третье основание | |||
| У | Ц | А | Г | ||
| У | Фен Фен Лей Лей |
Сер Сер Сер Сер |
Тир Тир — — |
Цис Цис — Три |
У Ц А Г |
| Ц | Лей Лей Лей Лей |
Про Про Про Про |
Гис Гис Глн Глн |
Арг Арг Арг Арг |
У Ц А Г |
| А | Иле Иле Иле Мет |
Тре Тре Тре Тре |
Асн Асн Лиз Лиз |
Сер Сер Арг Арг |
У Ц А Г |
| Г | Вал Вал Вал Вал |
Ала Ала Ала Ала |
Асп Асп Глу Глу |
Гли Гли Гли Гли |
У Ц А Г |
Для визуализации ПЦР-продукта после сайт-направленного мутагенеза ученые используют электрофорез в агарозном геле.
В основе данного метода лежит разделение заряженных частиц в электрическом поле. Электрофорез позволяет определить длину молекулы ДНК, которая наработана в результате ПЦР. Между тем, электрофорез можно использовать не только для разделения нуклеиновых кислот, но и белков.
Белки, аналогично нуклеиновым кислотам, обладают поверхностным зарядом. Однако суммарный заряд для каждого белка уникален и предопределяется рядом факторов:
- аминокислотная последовательность белка,
- аминокислотный состав белка,
- водородный показатель раствора, в котором растворен белок.
Для электрофоретического разделения белков наибольшую ценность представляет водородный показатель (pН), отражающий концентрацию протонов в среде.
Задание 7. По каким особенностям строения классифицируют аминокислоты? Как называется единственная аминокислота? Как называется единственная оптически неактивная аминокислота? (1 балл)
Ответ: по строению радикала; пролин; глицин.
Задание 8. Как называют связи, которые удерживают остатки аминокислот в первичной структуре белка? Перечислите, с помощью каких связей удерживается вторичная структура белка? (1 балл)
Ответ: пептидные (ковалентные); водородные, между пептидными связями разных витков.
Задание 9. Как называется аминокислота, наличие которой в последовательности белка ведет к повороту цепи? (1 балл)
Ответ: пролин.
В зависимости от рН-среды раствора полипептид может быть заряжен положительно, отрицательно или нейтрально, заряд полипептида тем временем складывается из зарядов аминокислот, входящих в его состав.
Задание 10. Определите, к катоду или к аноду будет мигрировать полипептид FENNGY при разном рН раствора? Обратите внимание, что в каноническом виде последовательность аминокислот принято записывать в направлении от N-конца к С-концу. Направление отметьте в таблице 1.1. (2 балла)
| рН раствора | К катоду | К аноду | Не движется |
|---|---|---|---|
| 3,9 | + | ||
| 6,0 | + | ||
| 10,9 | + |
Ответ: изоэлектрическая точка белка — это pH среды, при которой суммарный электрический заряд белка равен нулю; в упрощенном случае значение рН для изоэлектрической точки пептида (без учета боковых радикалов) вычисляется по формуле:
\[pI = \ \frac{{pKa}_{1} + {pKa}_{2}}{2}.\]
Задание 11. Рассчитайте значение рН изоэлектрической точки для дипептида VM. Определите, при каком максимальном значении рН молекула будет двигаться к катоду, и при каком минимальном рН — к аноду. (2 балла)
Ответ: на N-конце находится Val, на C-конце Met, вычислим \(pI (VM) = (9{,}62 + 2{,}28)/2 = 11{,}9/2 = 5{,}95\); при рН \(5{,}95\) пептид не будет иметь заряд и подвижность при электрофорезе; при снижении рН будет заряжен положительно, при повышении — отрицательно.
| Animo Acid | Abbreviaton | pK1 | pK2 | pKr | |
| 3-Letters | 1-Letters | -COOH- | \(\ce{-NH3+}\) | R group | |
| Alanine | Ala | A | 2,34 | 9,69 | — |
| Arginine | Arg | R | 2,17 | 9,04 | 12,48 |
| Asparagine | Asn | N | 2,02 | 8,80 | — |
| Aspartic Acid | Asp | D | 1,88 | 9,60 | 3,65 |
| Cysteine | Cys | C | 1,96 | 10,128 | 8,18 |
| Glutamis Acid | Glu | E | 2,19 | 9,67 | 4,25 |
| Glutamine | Gln | Q | 2,17 | 9,13 | — |
| Glycine | Gly | G | 2,34 | 9,60 | — |
| Histidine | His | H | 1,82 | 9,17 | 6,0 |
| Isoleucine | Ile | I | 2,36 | 9,60 | — |
| Leucine | Leu | L | 2,36 | 9,60 | — |
| Lysine | Lys | K | 2,18 | 8,95 | 10,53 |
| Methoinine | Met | M | 2,28 | 9,21 | — |
| Phenylalanine | Phe | F | 1,83 | 9,13 | — |
| Proline | Pro | P | 1,99 | 10,60 | — |
| Serine | Ser | S | 2,21 | 9,15 | — |
| Threonine | Thr | T | 2,09 | 9,10 | — |
| Tryptophan | Trp | W | 2,83 | 9,39 | — |
| Tyrosine | Tyr | Y | 2,20 | 9,11 | 10,07 |
| Valine | Val | V | 2,32 | 9,62 | — |
В биоинформатике анализ геномных данных играет ключевую роль в изучении генетических вариаций, которые могут влиять на функции генов и вызывать заболевания. Одним из важных этапов такого анализа является поиск мутаций в данных секвенирования, таких как инсерции (вставки) и делеции (удаления). SAM-файл (Sequence Alignment/Map), полученный после выравнивания прочтений на референсный геном с помощью программ вроде BWA или Bowtie, содержит информацию о позициях выравнивания и различиях между прочтениями и референсом. Эти различия, описанные в CIGAR строке, могут указывать на мутации.
Поиск мутаций важен не только для изучения генетических заболеваний и эволюции организмов, но и для геномного редактирования, где их точное определение дает возможность оценить эффективность инструментов вроде CRISPR-Cas9 и минимизировать off-target эффекты.
В данном задании следует:
- Проанализировать SAM-файл.
- Найти мутации.
- Определить координаты мутаций в геноме.
- Оценить частоту мутаций.
Это поможет развить навыки работы с биоинформатическими данными и понять принципы интерпретации геномных вариаций.
SAM-файл состоит из двух частей: заголовков и выравниваний. Заголовки начинаются с символа @ и содержат метаинформацию о референсном геноме и параметрах выравнивания. Строки выравнивания состоят из следующих столбцов (разделенных знаками пробела):
- название прочтения,
- флаг выравнивания,
- хромосома, на которую выровнялось прочтение,
- позиция выравнивания (координата начала выравнивания на хромосоме),
- качество выравнивания,
- строка CIGAR,
- другие данные.
CIGAR-строка (Compact Idiosyncratic Gapped Alignment Report) описывает, как read выравнивается на референсный геном. Она состоит из пар чисел и символов, где число указывает длину операции, а символ — ее тип.
Основные символы CIGAR строки:
- M (совпадение, Match),
- I (инсерция, Insertion),
- D (делеция, Deletion),
- S (мягкое клиппирование, Soft clipping),
- N (пропуск в референсе, Skipped region).
Например, строка 3M1D4M означает, что первые 3 нуклеотида read совпадают с референсом, затем следует делеция 1 нуклеотида, а после — еще 4 совпадающих нуклеотида.
Задача
Напишите программу, которая будет принимать на вход файл в формате Sam. Программа должна считать этот файл и найти в нем строки с мутациями. Для каждой мутации программа должна записать название по следующему шаблону: [тип мутации (del — делеция или ins — инсерция)]_[хромосома]_[координата начала мутации]_[координата конца мутации], например: del_chr1_100_105, ins_chr7_100_101. Затем программа должна подсчитать частоту каждой мутации и вывести на экран мутации с частотой > 10% в порядке убывания частоты.
Пример входного файла: Test_alignment.sam
Правильный вывод для этого файла:
del_chr1_108_108
ins_chr1_141_142.
- Реализовано считывание входного файла — 1 балл.
- Реализован поиск строк с мутацией — 2 балла.
- Реализована запись мутации по образцу — 3 балла.
- Реализовано определение частоты мутации — 3 балла.
- Реализован вывод на экран мутаций с частотой > 10% в порядке убывания частоты — 1 балл.
def read_sam(Test_alignment):
mutations={}
with open(Test_alignment, "r") as file:
for line in file:
if (line.startswith("@")):
continue
st=line.split()
chrom=st[2]
posis=int(st[3])
cigar=st[5]
i=0
while i<len(cigar):
num=""
while i<len(cigar) and cigar[i].isdigit():
num+=cigar[i]
i+=1
if (i<len(cigar)):
letter=cigar[i]
if (letter=="D"):
s=posis
e=posis+int(num)-1
mut=f"del_{chrom}_{s}_{e}"
mutations[mut]=mutations.get(mut, 0)+1
posis+=int(num)
elif (letter=="I"):
s=posis
e=posis+int(num)-1
mut=f"ins_{chrom}_{s}_{e}"
if(mut=="ins_chr1_141_142"):
mutations[mut]=mutations.get(mut, 0)+1
else:
posis+=int(num)
i+=1
return mutations
def chastota(mutations):
s=sum(mutations.values())
return {k: ((v/s)*100) for k, v in mutations.items()}
def glavnai(Test_alignment):
mutations=read_sam(Test_alignment)
sty=chastota(mutations)
filtr={k: v for k, v in sty.items() if (v>10)}
sort=sorted(filtr.items(), key=lambda x: x[1], reverse=True)
for mutation, w in sort:
print(f"{mutation}")
glavnai("Test_alignment.sam")
Оборудование и реактивы:
- Продукт ПЦР, полученный в первый день плазмида pQE30-mutGFP, если ПЦР прошла неудачно (пробирка 0,6 мл).
- Электрокомпетентные клетки E. coli штамм BL21, 50 мкл (1 пробирка, 0,6 мл).
- Среда SOC, 950 мкл (1 пробирка, 1,5 мл).
- 1 М ИПТГ (изопропил-бета-D-тиогалактозид).
- Супероптимальная среда c катаболической репрессией SOC 1 мл (от англ. Super Optimal broth with Catabolite repression): 2% триптон, 0,5% дрожжевой экстракт, 10 мМ \(\ce{NaCl}\), 2,5 мМ \(\ce{KCl}\), 10 мМ \(\ce{MgCl2}\), 10 мМ \(\ce{MgSO4}\), 20 мМ глюкоза.
- 0,8%-й раствор \(\ce{NaCl}\).
- Чашки Петри с агаризованной средой LB с ампициллином.
- Одноразовые шпатели Дригальского.
- Спиртовка.
- Термостат для пробирок.
- Центрифуга.
- Инкубатор с перемешиванием.
- Инкубатор для чашек Петри.
- Автоматический дозатор объемом 1–10 мкл и 20–200 мкл.
- Наконечники для дозатора 10 мкл, 200 мкл, 1000 мкл.
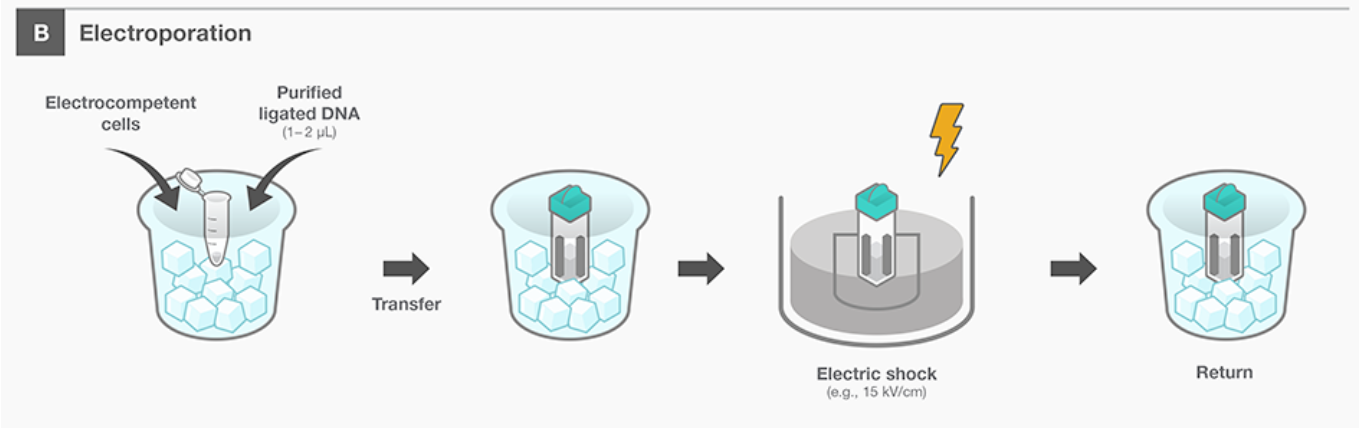
Протокол электропорации
- Пробирки со средой SOC разморозить в термостате при 37 °C.
- Бактериальные клетки разморозить на льду (5–10 мин).
- Плазмиды и кюветы для электропорации охладить на льду.
- Добавить 1 мкл плазмиды или ПЦР-продукта в пробирку с клетками.
- Перенести клеточную суспензию в кювету для электропорации и равномерно распределить.
- Поместить кювету в электропоратор.
- Запустить программу Ecl, нажать кнопку
pulseдля электрического импульса. - Быстро добавить к клеткам теплую среду SOC.
- Аккуратно ресуспендировать клетки в кювете, перенести в пробирку, подписать.
- Инкубировать электропорированные клетки в шейкер-инкубаторе при 37 °C в течение 30–60 мин.
Перенос бактерий на чашку Петри (порядок действий):
- Открутить клетки на настольной центрифуге при 6000 rpm в течение 3 мин.
- Занести пробирки с клетками под ламинар.
- Аккуратно слить супернатант, оставить на дне 20–50 мкл жидкости.
- Ресуспендировать клетки.
- Втереть в чашку Петри 40 мкл 1 М ИПТГ стерильным шпателем Дригальского.
- Перенести бактерии на чашку Петри, растереть (можно тем же) шпателем Дригальского до полного впитывания. Подписать чашку Петри со стороны среды.
- Инкубировать чашки Петри в инкубаторе при 37 °C в течение ночи.
На контрольную чашку организатор наносит бактерии, трансформированные по тому же протоколу плазмидой pQE30-GFP, с немутированным геном GFP.
Сегодня на практике участники ознакомились с одним из методов трансформации клеток.
Трансформация представляет собой процесс поглощения инородного генетического материала клетками с последующей его интеграцией в свой геном. В природе трансформация — один из способов горизонтального переноса генов. Она помогает бактериям выживать по ряду причин:
- позволяет им быстро адаптироваться к изменениям в окружающей среде, получая гены, которые обеспечивают устойчивость к антибиотикам или другим стрессовым факторам,
- способствует генетическому разнообразию, что увеличивает шансы на выживание популяции в условиях естественного отбора,
- дает возможность приобретать новые метаболические пути и функции, позволяя использовать различные источники пищи и ресурсы.
Трансформацию широко применяют в молекулярной биологии и генной инженерии.
Сегодня были использованы компетентные клетки E. coli штамма BL21(DE3). Их заранее обрабатывают для повышения способности поглощать чужеродную ДНК из окружающей среды. Клетки E. coli были трансформированы двумя разными плазмидами: первая несет в себе ген, кодирующий белок GFP (контрольная), вторая — содержит мутацию в этом гене (она была получена в первый день).
Задание 1. Какие другие методы используют для трансформации бактериальных клеток? Кратко опишите суть этих методов. (1 балл)
Ответ: два основных метода, используемых в лаборатории — электропорация и химическая трансформация; при химической трансформации используют компетентные клетки, выращенные и быстро замороженные в среде \(\ce{CaCl2}\); клеткам добавляют плазмиду и проводят «тепловой шок» — нагревают до 42 °C. В результате клетки захватывают плазмидную ДНК и происходит трансформация.
Задание 2. Опишите, для чего нужен шаг, на котором смесь клеток с плазмидой после электропорации перемещают в среду SOC? (2 балла)
Ответ: в среде SOC существуют оптимальные условия для роста клеток, происходит наработка продуктов генов устойчивости к антибиотикам; клетка репарирует повреждения ДНК (например, возникающие при мутагенезе), делится 1–2 раза, и выживают только клетки с относительно целым геномом.
Задание 3. Какие структурные элементы должна содержать плазмида для эффективной наработки белка в клетках? (2 балла)
Ответ: промотор, терминатор, регуляторные элементы, необходимые для транскрипции и трансляции мРНК.
Задание 4. Почему в научных лабораториях используют специально разработанные штаммы бактерий, а не их дикие варианты? Чем отличаются эти штаммы? (2 балла)
Ответ: штаммы для экспрессии белков содержат мутации, которые стабилизируют структуру белка, способствуют его укладке, снижают деградацию мРНК, делают возможной индукцию экспрессии целевого гена.
После трансформации клетки помещаются в питательную среду SOC, затем высеиваются на чашки Петри, в которых заранее подготовлена питательная среда LB (lysogeny broth). Основными компонентами этой питательной среды выступают триптон, экстракт дрожжей, \(\ce{NaCl}\) и агар. Кроме того, до застывания в питательную среду был добавлен антибиотик Ампициллин, а после застывания на поверхность нанесли ИПТГ (изопропил-бета-D-тиогалактозид).
Задание 5. Опишите, какие функции выполняет каждый из основных компонентов питательной среды LB. Для чего добавляют антибиотик и ИПТГ? (2 балла)
Ответ: триптон, дрожжевой экстракт — питательные вещества для роста бактерий; агар — для того, чтобы сделать среду твердой, пригодной для роста колоний бактерий; антибиотик — для того, чтобы выявить бактерии, которые содержат плазмиду; ИПТГ — для индукции экспрессии целевого гена.
Один из организаторов готовил среду для всех команд-финалистов. Предлагаем повторить все расчеты, которые понадобились ему в ходе приготовления реактивов. Исходно в лаборатории есть сухие реактивы: триптон, экстракт дрожжей, NaCl и агар, а также 1М раствор ИПТГ и 100 мг/мл раствор ампициллина.
Задание 6. Рассчитайте, каким должен быть конечный объем питательной среды, которую делает организатор, если на финале будет 7 команд, каждой команде нужно по 3 чашки Петри (объем чашки Петри примерно 30 мл, среда занимает 1/3 объема). Учтите, что на случай непредвиденных ситуаций организаторы готовят все реактивы с избытком в 1,5 раза. (2 балла)
Ответ: 315 мл.
Задание 7. Рассчитайте массы основных компонентов этой среды, если известно, что массовая доля агара в конечной смеси составляет 1,45%, триптона — 1%, NaCl и дрожжевой экстракт — по 0,5%. Для расчетов примите, что в растопленном виде плотность среды равна плотности воды. Какой объем исходного раствора антибиотика необходимо взять, если он должен составлять тысячную часть от объема среды? (2 балла)
Ответ: агар — 4,56 г; триптон — 3,15 г; хлорид натрия — 1,57 г; дрожжевой экстракт — 1,57 г; антибиотик — 315 мкл.
Задание 8. Чтобы участники смогли самостоятельно нанести на каждую чашку Петри 40 мкл 100 мМ ИПТГ, организатору необходимо приготовить каждой команде по 1 пробирке, из которой команда будет наносить ИПТГ на все свои чашки. Какой итоговый объем должен получиться у организатора в пробирке для каждой команды (не забудьте, что все реактивы готовятся с полуторным избытком)? Какой объем исходного раствора ИПТГ организатору нужно добавить в пробирку для каждой команды, чтобы получить нужную концентрацию? (2 балла)
Ответ: 180 мкл.
Участникам предоставлена аминокислотная последовательность белка неизвестного происхождения. Поставлена задача — проанализировать этот белок с использованием базы данных, NCBI, UniProt, PDB и ответить на следующие вопросы:
- Найдите гомологичные белки с помощью инструмента BLAST. Какие белки имеют наибольшее сходство с предоставленной последовательностью? Укажите их идентификаторы (ID) и организмы.
- Найдите этот белок в базе данных PDB и посмотрите трехмерную структуру. Какие элементы вторичной структуры присутствуют в этом белке?
- Какие функциональные домены присутствуют в этом белке? Почему они важны для его функции?
- К какому биологическому процессу относится этот белок?
- Есть ли у этого белка посттрансляционные модификации? Если да, то какие и как они могут влиять на его функцию?
- Есть ли у этого белка изоформы? Если да, то как они отличаются?
- Какие взаимодействия с другими белками характерны для этого белка?
Фрагмент последовательности: metpsqrrat rsgaqasstp lsptritrlq ekedlqelnd rlavyidrvr sletenaglr.
Вопрос 1. Представлены 25 самых схожих последовательностей, их было больше. Все они имели низкий E-value и в большинстве представляли собой последовательность Ламина А/С.
- Neotoma lepida OBS64991.1
- Homo sapiens AHI07399.1
- Homo sapiens KAI2519636.1
- Homo sapiens KAI2519635.1
- Saguinus oedipus KAK2084423.1
- Homo sapiens KAI2519634.1
- Piliocolobus tephrosceles XP_023069786.1
- Puma concolor XP_025770955.1
- Homo sapiens KAI2519631.1
- Homo sapiens 6JLB_A
- Homo sapiens AAH33088.1
- Pongo abelii PNJ56704.1
- Gracilinanus agilis XP_044540329.1
- Homo sapiens ABB04050.1
- Homo sapiens AAW32539.1
- Rhinolophus ferrumequinum KAF6293089.1
- Homo sapiens KAI2519630.1
- Panthera uncia XP_049490771.1
- Ovis canadensis XP_069400509.1
- Bos taurus NP_001029225.1
- Sus scrofa AAY44742.1
- Pongo pygmaeus XP_054325363.1
- Phyllostomus discolor KAF6074864.1
- Sigmodon hispidus KAL1778273.1
- Myotis myotis KAF6290871.1
Вопрос 2. Данный белок включает в свою структуру несколько альфа-спиралей и неспиральные N-конец и C-конец. С-конец содержит имунноглобулин-подобный домен (Ig), который в свою очередь содержит бета-слои.
Вопрос 3. C-конец и N-конец белка участвуют в формировании продольных взаимодействий, что позволяет формировать промежуточные филаменты. Это важно, так как позволяет создавать ламиновый каркас на внутренней стороне ядерной мембраны.
Помимо того, основной альфа-спиральный домен белка, необходимый для выполнения белком функции по созданию каркаса для ядерной оболочки, содержит домены для образования связей в димерах белка (гидрофобный шов на одной из альфа-спиралей). Белок содержит домены, позволяющие ему связывать хроматин (Ig-fold), поэтому он может соединять хроматин и ядерную оболочку.
Глобулярный Ig-fold-домен участвует в формировании связей с другими белками (титин, актин, PCNA), что имеет большое значение для осуществления его воздействия на репликацию и структурных взаимодействий. Кроме того, в структуре белка есть последовательность, отвечающая за его транспорт в ядро после синтеза (NLS).
Вопрос 4. Данный белок участвует в процессе организации хроматина и сборке оболочки ядра. Помимо этого, белок связан с процессом деления клетки, поскольку при делении разрушение ядерной оболочки связано с его фосфорилированием и разрушением связей между его филаментами.
Некоторые белки участвуют в репарации ДНК: привлекаются белками репарации ДНК XRCC4 и IFFO1 к двухцепочечным разрывам ДНК (DSB) для предотвращения транслокации хромосом путем иммобилизации разорванных концов ДНК, регуляции экспрессии генов, репликации (благодаря связыванию через Ig-fold домен PCNA).
Вопрос 5. Да, А-Ламин претерпевает фанерзилирование, запускающее удаление последнего трипептида с C-конца и после этого претерпевает метилирование для своего созревания. Помимо этого, ламины испытывают сайт-специфическое фосфорилирование, что способствует либо их нацеливанию на ядерную мембрану и сборке в ее промежуточные филаменты, либо, наоборот, способствует разборке промежуточных филаментов в зависимости от изоформы и сайта.
Вопрос 6. Да, есть: A, B1, B2, C. Изоформы A и C — результат альтернативного сплайсинга одного гена LMNA, они имеют общие последовательности аминокислот (566), B1 и B2 — продукты разных других генов с высокой схожестью. Кроме того, как результат альтернативного сплайсинга LMNA выделяют второстепенные изоформы A\(\Delta\)10 и C2.
Вопрос 7. Разные изоформы ламина способны взаимодействовать друг с другом, образуя гомодимеры и гетеродимеры. Данный белок также взаимодействует с титином в мышцах с белком, увеличивающим процессивность ДНК-полимеразы PCNA. Помимо этого, они взаимодействуют с внутренними белками ядерной мембраны, в том числе другим структурным белком, эмерином, интегральными белками, прикрепляющими их к мембране ядра (LBR).
Оборудование и реактивы:
- Комплект плазмид для идентификации (пробирки 0,6 мл с цифровыми обозначениями ___ и ___) по 11 мкл плазмиды с концентрацией 40 нг/мкл.
- Рестрикционные буферы: 10хSE-буфер B, 10хSE-буфер G, 10хSE-буфер O, 10хSE-буфер W, 10хSE-буфер Y, 10хSE-буфер ROSE (Сибэнзайм).
- Эндонуклеазы рестрикции: Acc16 I, 5 ед./мкл, BamH I, 5 ед./мкл, Pst I, 5 ед./мкл, Vne I, 5 ед./мкл (Сибэнзайм).
- Деионизованная вода класса milliQ (1 мл).
- Автоматические дозаторы объемом 1–10 мкл, 20–200 мкл.
- Наконечники для автоматического дозатора: 10 мкл, 200 мкл.
- Термостат.
Задание
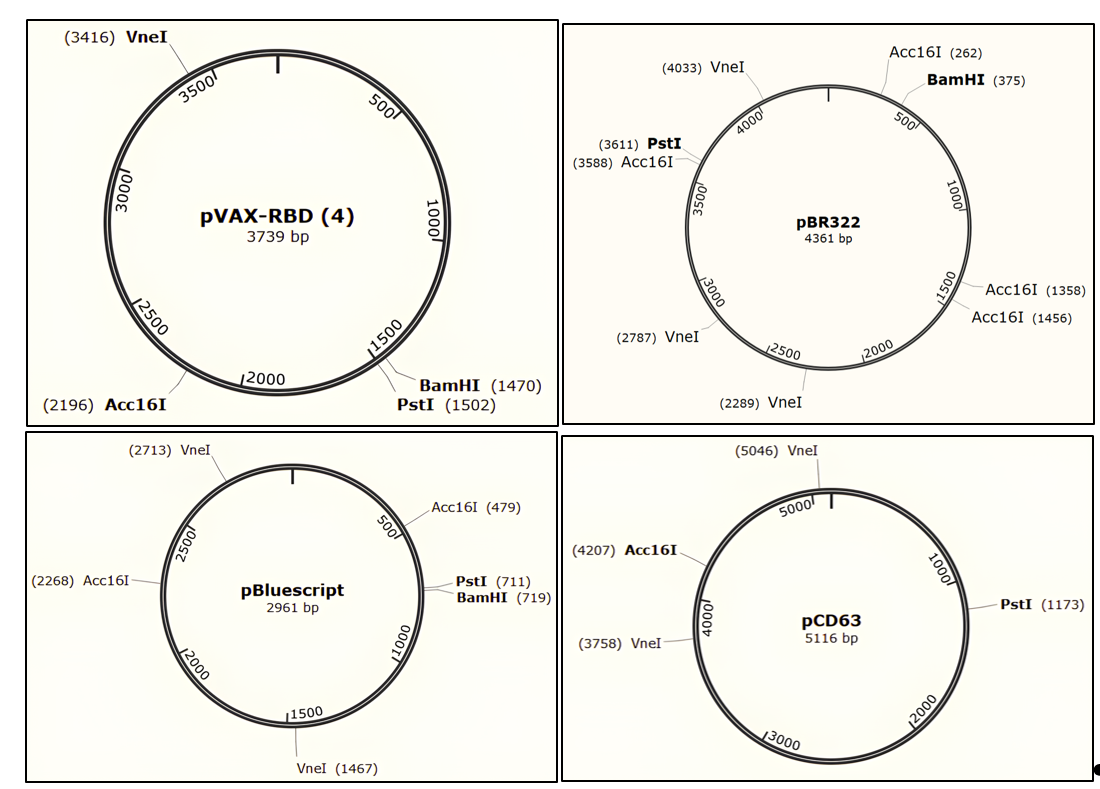
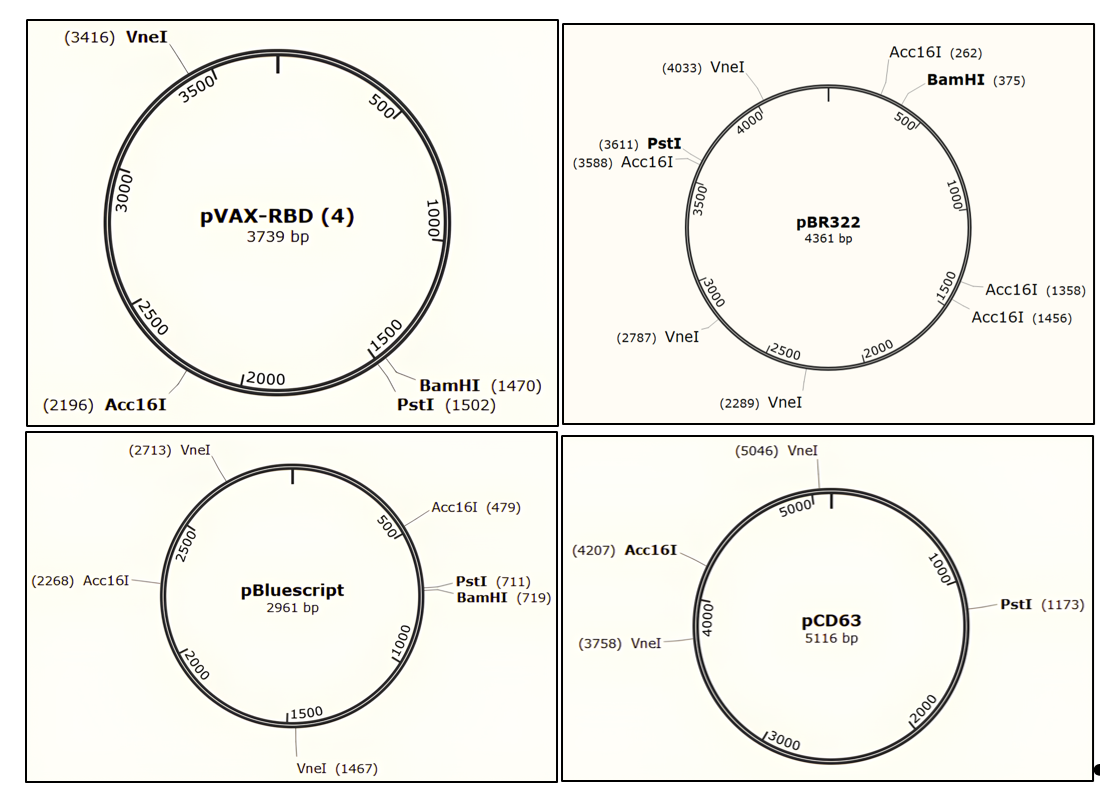
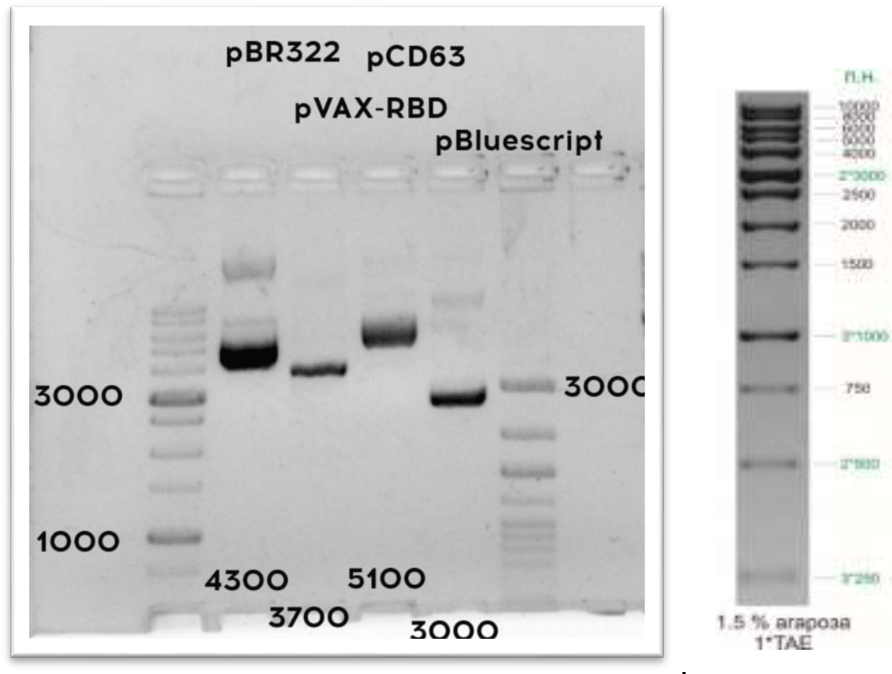
В ходе данной работы необходимо с помощью рестрикицонного анализа определить, какие две плазмиды выданы. Карты плазмид представлены на схеме: обозначены название, размер плазмиды, а также расположение сайтов, по которым гидролизуют эндонуклеазы рестрикции Acc16 I, BamH I, Pst I и Vne I.
Для анализа необходимо использовать пару эндонуклеаз рестрикции, то есть одновременно в одной пробирке провести гидролиз ДНК плазмиды двумя ферментами (Acc16 I + BamH I) или (Pst I + Vne I). В результате у каждой команды получится по четыре пробирки с реакционными смесями.
Для того чтобы рестриктазы работали корректно, нужно подобрать для них оптимальный реакционный буфер. При использовании неоптимального буфера возможно появление звездчатой активности — снижения или изменения специфичности эндонуклеаз рестрикции (https://ru.wikipedia.org/wiki/Эндонуклеазы_рестрикции). В результате фермент будет неизбирательно разрезать ДНК, и полученные в ходе такого эксперимента данные не позволят правильно идентифицировать плазмиду.
Ниже представлена таблица 1.2, отображающая активность эндонулкеаз рестрикции в разных буферных растворах. Следует подобрать для каждой пары рестриктаз оптимальный буферный растворы и провести рестрикционный анализ плазмид согласно протоколу.
| Фермент | Сайт узнавания | Активность в буфере, % от максимальной | Оптимальная температура, °C | |||||
| B | G | O | W | Y | R | |||
| Acc16 I | TGC\(\uparrow\)GCA ACG\(\downarrow\)CGT |
50–75 | 75– 100 | 25–50 | 100 | 75–100 | 70 | 37 |
| BamH I | G\(\uparrow\)GATCC CCTAG\(\downarrow\)G |
25–50 | 100 | 75–100 | 75–100 | 25–50 | 100 | 37 |
| Pst I | CTGCA\(\uparrow\)G G\(\downarrow\)ACGTC |
10– 25 | 25–50 | 1100 | 25– 50 | 25– 50 | 50 | 37 |
| Vne I | G\(\uparrow\)TGCAC CACGT\(\downarrow\)G |
10–25 | 25-50 | 100 | 25–50 | 25–50 | 100 | 37 |
Протокол:
- Возьмите две чистые пробирки объемом 0,6 мл и подпишите их так же, как обозначены две неизвестные выданные плазмиды.
- На обеих пробирках поставьте обозначение «A+B» («A» обозначает эндонуклеазу рестрикции Acc16 I, «B» — эндонуклеазу рестрикции BamH I).
- Возьмите еще две чистые пробирки объемом 0,6 мл и снова подпишите их так же, как обозначены две неизвестные выданные плазмиды.
- На обеих пробирках поставьте обозначение «P+V» («P» обозначает эндонуклеазу рестрикции Pst I, «V» — эндонуклеазу рестрикции Vne I).
- Внесите в каждую из пробирок соответствующие реагенты в количестве, указанном в таблице 1.3. Порядок добавления реагентов следующий: вода mQ, 10Х буфер, плазмиды, рестриктазы (по 2 шт!). Конечный объем реакционной смеси — 10 мкл.
- Поместите реакционные смеси в твердотельный термостат на 37 °C на 30 мин.
| Компонент | Плазмида «__» «A+B» | Плазмида «__» «A+B» | Плазмида «__» «P+V» | Плазмида «__» «P+V» |
|---|---|---|---|---|
| milliQ | мкл | мкл | мкл | мкл |
| 10Х буфер | мкл | мкл | мкл | мкл |
| Название буфера | ||||
| Плазмида «__» | 4 мкл | — | 4 мкл | — |
| Плазмида «__» | — | 4 мкл | — | 4 мкл |
| Acc16 I | 1 мкл | 1 мкл | — | — |
| BamH I | 1 мкл | 1 мкл | — | — |
| Pst I | — | — | 1 мкл | 1 мкл |
| Vne I | — | — | 1 мкл | 1 мкл |
Оборудование и реактивы:
- Агароза, буфер 1\(\times\)TAE, маркер длин ДНК.
- Камера для горизонтального электрофореза.
- Трансиллюминатор.
- Автоматические дозаторы объемом 1–10 мкл.
- Наконечники для дозатора 10 мкл.
Протокол:
- Для приготовления геля прилейте к навеске агарозы массой 1 г 100 мл 1\(\times\)TAE, доведите до кипения и растворите всю навеску при перемешивании.
- После остывания раствора агарозы установите в форму гребенки и перелейте раствор агарозы.
- Добавьте к образцам по ___ мкл 4Х красителя для нанесения на гель.
- Нанесите на гель весь объем каждой из реакционных смесей с буфером для нанесения, запишите порядок нанесения образцов.
- Нанесите на агарозный гель маркер длин ДНК.
- Запустите электрофорез в следующих условиях: 120 В, 40 мин.
- Получите изображения геля после электрофореза с помощью трансиллюминатора.
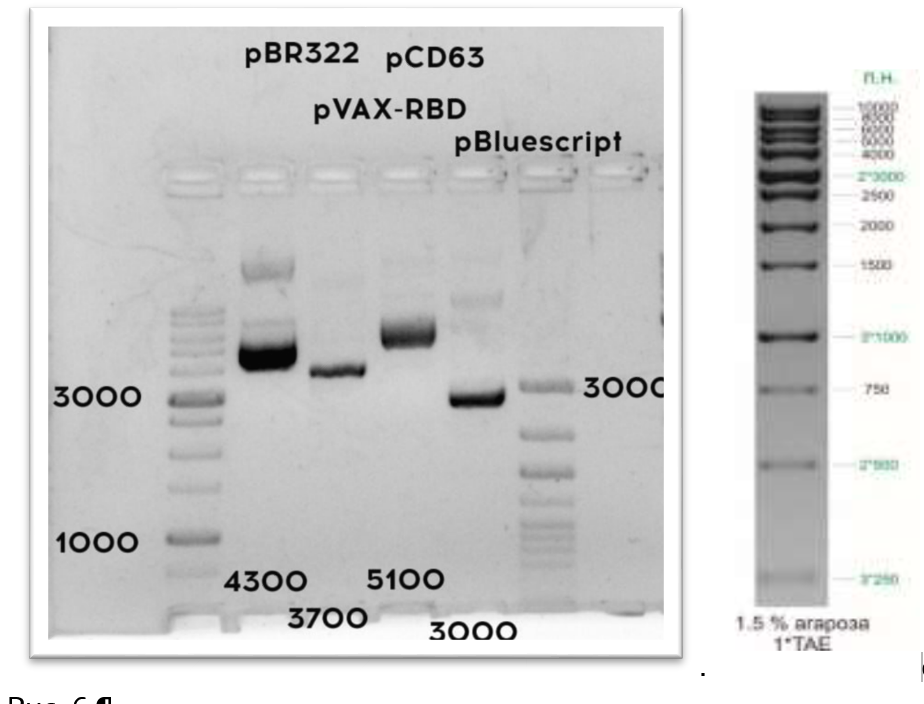
- Проведите анализ продуктов рестрикции, установите, какие плазмиды были выданы вашей команде.
Задание 1. Определите, какие плазмиды вам были выданы?
Плазмида ____, плазмида ____.
Задание 2. Используя карты плазмид pVAX-RBD, pBR322, pBluescript и pCD63, вычислите размеры продуктов, которые должны получиться в результате гидролиза этих плазмид эндонуклеазами рестрикции.
| Плазмиды | Эндонуклеазы рестрикции | Длина продуктов, п. н. |
|---|---|---|
| pVAX-RBD | Acc16 I + BamH I | |
| Pst I + Vne I | ||
| pBR322 | Acc16 I + BamH I | |
| Pst I + Vne I | ||
| pBluescript | Acc16 I + BamH I | |
| Pst I + Vne I | ||
| pCD63 | Acc16 I + BamH I | |
| Pst I + Vne I |
Сегодня в ходе лабораторной работы предстоит проводить рестрикционный анализ. Рестриктазы — это ферменты, которые способны распознавать специфические последовательности ДНК и разрезать их в определенных местах. Впервые они были обнаружены у бактерий, где выполняли защитную функцию, разрушая чужеродную ДНК, например, вирусную.
Рестриктазы широко используются в лабораторных условиях для создания рекомбинантных молекул ДНК. С их помощью ученые могут вырезать нужные фрагменты ДНК и вставлять их в другие молекулы, например, в плазмиды или векторы. Это позволяет клонировать гены, изучать их функции, создавать генетически модифицированные организмы и разрабатывать новые методы лечения заболеваний. Кроме того, рестриктазы применяются, например, в секвенировании для получения коротких фрагментов ДНК, которые будет возможно «прочитать».
Задание 3. Студент проводил эксперимент: взял 200 нг ДНК и добавил в реакционную не 1 мкл рестриктазы, а 10 мкл, после чего после гель-электрофореза увидел только пустую дорожку. Предположите, из-за чего так произошло?
Ответ: избыток рестриктазы гидролизовал ДНК не только по специфическим сайтам рестрикции, в результате чего образовались короткие продукты, которые не видны на электрофорезе.
Задание 4. После этого студент решил переделать эксперимент, но в этот раз забыл добавить в реакционную смесь буферный раствор. Что он увидит на электрофорезе и почему? Какие необходимые для рестриктаз компоненты содержит буферный раствор?
Ответ: в отсутствие буферного раствора рестриктаза не будет проявлять активность, либо активность будет сильно снижена; буферный раствор содержит соли и вещества, поддерживающие рН раствора.
Райан Гослинг устроился в лабораторию нейрофизиологии, где основной спектр исследований сводится к изучению дофаминовых рецепторов человека. Они играют заметную роль в создании приятных эмоций и тягу к стремлению к чему-то новому.
В настоящий момент у человека идентифицированы пять типов дофаминовых рецепторов: D1, D2, D3, D4 и D5. По некоторым научным данным, за чувство удовольствия от поиска новизны отвечает рецептор D4, кодирующийся геномом DRD4. Именно он определяет, сколько удовольствия человек получит при совершении чего-то нового или удивительного.
Одна из вариаций рецептора D4 в головном мозге приводит к пониженной чувствительности к удовлетворению после испытанной новизны, в силу этого люди, имеющие такую особенность, более склонны к совершению рискованных поступков, например, прыжки с парашютом, покорение горных вершин, кругосветное путешествие. Поэтому этой аллели дали название «ген авантюризма».
Представим на секунду, что Райан Гослинг — ваш подопечный в проекте, где необходимо из культуры человеческих клеток достать ген, кодирующий данный рецептор, и клонировать его в плазмиду. Для этого нужно провести ряд манипуляций. Отвечая на вопросы, составьте план, по которому можно правильно провести клонирование человеческого гена в плазмиду.
Задание 5. Почему для успешного клонирования гена DRD4 необходимо выделять из клеток молекулу РНК, а не ДНК?
Ответ: требуется выделить именно продукт того гена, который работает в головном мозге, для этого необходимо использовать мРНК.
Задание 6. Фермент Х используется для получения комплементарной молекулы ДНК по матрице молекулы РНК. Как называется фермент Х?
Ответ: обратная транскриптаза (ревертаза).
Задание 7. Какие организмы содержат фермент Х? С какой целью они используют его?
Ответ: например, ретровирусы используют обратную транскриптазу в жизненном цикле для синтеза кДНК и интеграции в геном; геном человека содержит множество ретротранспозонов, многие из которых кодируют функциональную обратную транскриптазу; кроме того, активный центр обратной транскриптазы содержит теломераза.
Задание 8. В результате прошлых опытов была получена последовательность комплементарной ДНК гена DRD4. Следующая цель — вставить данный ген в плазмиду. Однако для этого необходимо к последовательности добавить сайты рестрикции. Предложите способ, как можно это сделать, используя один из методов молекулярной биологии.
Ответ: например, добавить сайты рестрикции можно с помощью ПЦР; для этого к \(5^\prime\)-концам праймеров добавляют последовательность сайта рестрикции и несколько нуклеотидов «с краю», чтобы обеспечить место для посадки рестриктазы.
Задание 9. Напишите план, по которому вы будете клонировать кДНК гена DRD4 в плазмиду. Составьте список ферментов для использования при всех имеющихся манипуляциях. Укажите назначение этих ферментов в данном эксперименте.
Ответ: если кДНК уже наработана, то нужны рестриктаза для получения липких концов в ПЦР-продукте и гидролиза плазмиды и ДНК-лигаза для лигирования ПЦР-продукта в плазмиду; если кДНК еще не наработана, то обратная транскриптаза (и обратный праймер), а также ДНК-полимераза для проведения ПЦР.
В мифологии химера — это огнедышащее существо с элементами различных животных, например, с головой и телом льва и хвостом змеи, из спины которого вырастает козья голова.
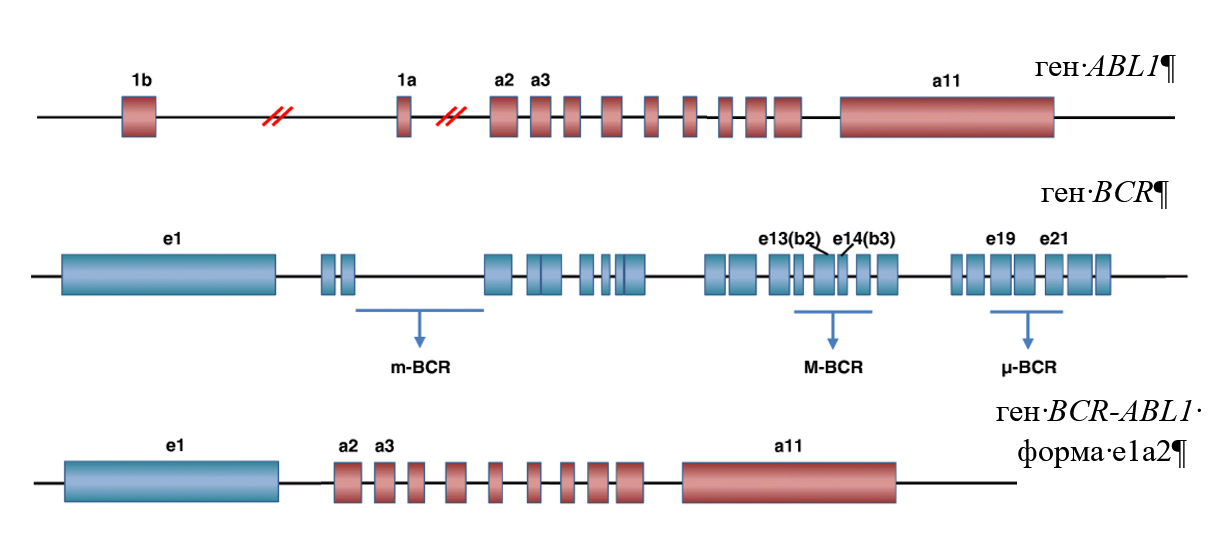
В молекулярной биологии также встречаются свои химеры. Одна из них — филадельфийская хромосома, возникающая вследствие реципрокной транслокации генетического материала между частями генов ABL1 хромосомы 9 и BCR хромосомы 22. Эта геномная аномалия является частой причиной возникновения онкологических заболеваний системы кроветворения, таких как хронический миелоидный лейкоз и острый лимфобластный лейкоз.
Разрывы генов могут происходить в разных их частях, и возможны разные места слияния участков ДНК. Так, одной из возможных форм химерного гена BCR-ABL1 является форма e1a2 (место слияния находится между экзоном 1 гена BCR и экзоном 2 гена ABL1).
Задание 1. Используя данные о последовательностях экзонов генов ABL1 и BCR человека из базы данных Ensembl (для однозначности используете последовательности экзонов ENST00000318560.6 и ENST00000305877.13), определите правильную последовательность химерного гена BCR-ABL1 формы e1a2 без учета последовательностей интронов. В качестве ответа предоставьте файл формата gbr с последовательностью и укажите длину полученной последовательности.
Ответ: длина 7037 bp, файл в папке https://disk.yandex.ru/d/YoyGQoppUw5Cfg/8-9/.
Вы поставили задачу — создать модельную линию эукариотических клеток, стабильно экспрессирующих ген BCR-ABL1. Данная модель может быть использована при разработке новых диагностических систем и лекарственных препаратов.
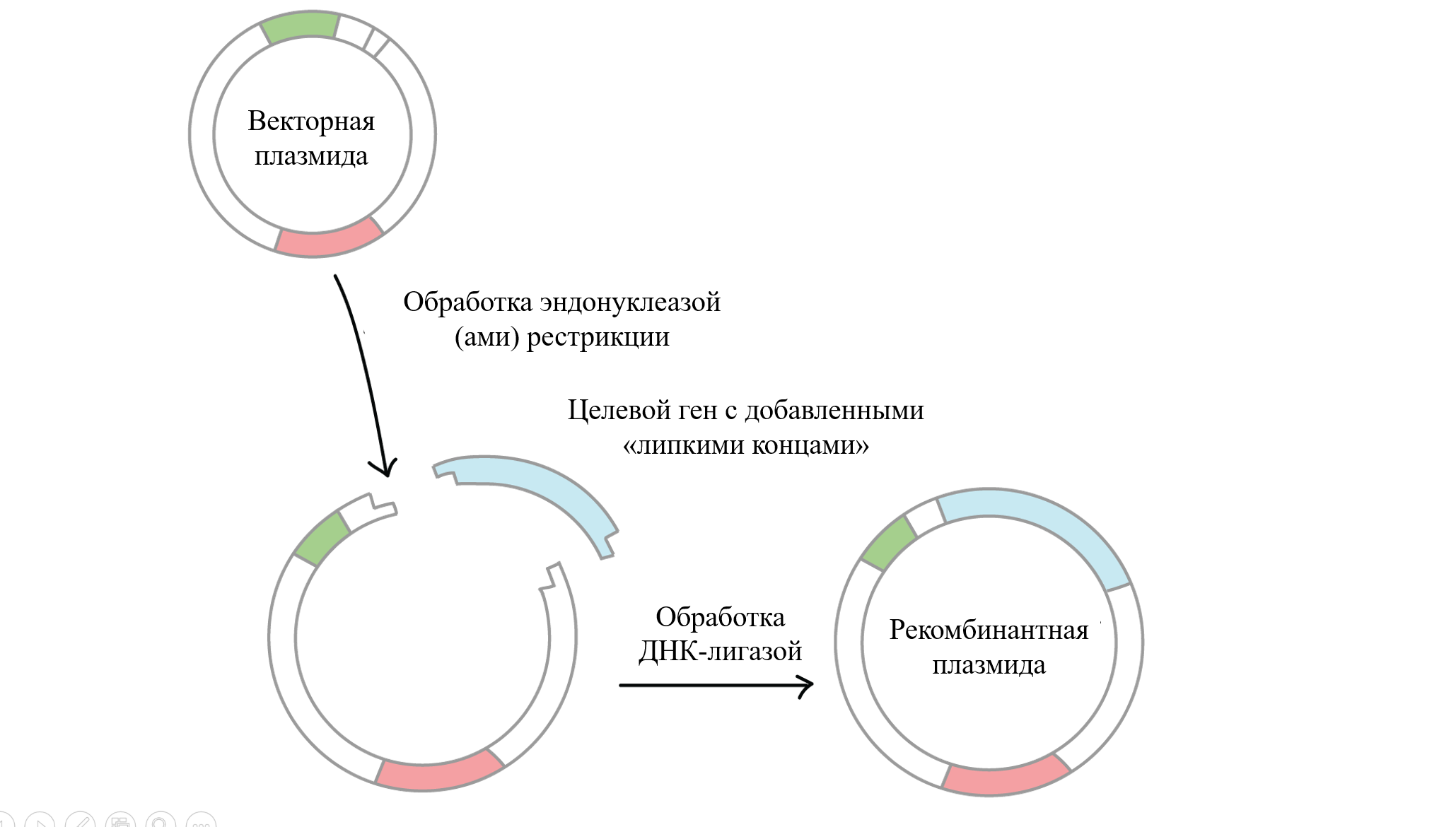
Для достижения этой цели вы решили клонировать ген BCR-ABL1 методом рестрикции и лигирования по «липким концам», поэтому необходимо выбрать подходящий плазмидный вектор и гидролизовать его определенными эндонуклеазами рестрикции для получения его линеаризованной формы с «липкими концами». Кроме того, нужно амплифицировать ген BCR-ABL1 с использованием пары праймеров, содержащих вложенные дополнительные «липкие концы».
Следующий шаг — проведение реакции лигирования вектора и амплифицированной последовательности гена для получения рекомбинантной плазмиды.
Наконец, необходимо проверить качество клонирования рестрикционным анализом.
Задание 2. Выберите из предоставленных плазмидных векторов подходящий для описанной задачи. При выборе учитывайте наличие всех необходимых элементов для эффективной экспрессии гена BCR-ABL1 в эукариотических клетках, а также возможность получения большого числа копий полученной рекомбинантной плазмиды в бактериях.
Определите эндонуклеазу(ы) рестрикции, которую(ые) можно использовать для получения линейной формы выбранного вами вектора с «липкими концами» для последующего клонирования гена BCR-ABL1. В качестве ответа предоставьте названия выбранных вами вектора и эндонуклеаз(ы) рестрикции. Аргументируйте свой выбор.
Ответ: pCMV v3 плазмида содержит ori и селективный маркер для получения большого числа копий полученной рекомбинантной плазмиды в бактериях, а также содержит ori и селективный маркер для экспрессии генов в эукариотических клетках; кроме того, присутствует multiple cloning site (MCS) с уникальными сайтами рестрикции для получения линеаризованного вектора с «липкими концами»; MCS фланкирован промотором CMV и \(\beta\)-globin poly(A) signal для эффективной экспрессии целевого гена); эндонуклеазы рестрикции BmtI и SacI находятся в области MCS, обладают единственным в плазмиде сайтом рестрикции и позволяют линеаризовать плазмиду pCMV v3 с получением «липких» концов для клонирования.
Также см. файлы в папке https://disk.yandex.ru/d/YoyGQoppUw5Cfg/8-9/.
Задание 3. Подберите прямой и обратный праймеры для амплификации гена BCR-ABL1 для дальнейшего клонирования. Для этого используйте последовательность гена BCR-ABL1, полученную в задании 1 (без интронов). К подобранным праймерам добавьте «липкие концы» для клонирования, соответствующие «липким концам» линеаризованной векторной плазмиды из задания 2.
Учитывайте, что температуры плавления итоговых прямого и обратного праймера должны быть примерно одинаковы \(\pm 2\) °C (55–60 °C), кроме того, праймеры не должны образовывать шпилечных структур. Используйте OligoCalc для оценки качества подобранных праймеров.
В качестве ответа файлом txt предоставьте последовательность прямого и обратного праймера от 5 (с указанием, где прямой праймер, а где — обратный). Для каждого из них укажите температуру плавления.
Ответ: прямой праймер — GATCGCAGAGTGCGGGC (температура плавления 60 °C); обратный праймер — TCGATTCTAATGTAAACACTGATTT (температура плавления 58 °C); не образовывают шпилечных структур и не нарушают последовательности экзонов целевого гена.
Задание 4. Предоставьте последовательность полученной в результате клонирования рекомбинантной последовательности в формате gbr.
Ответ: см. файл в папке https://disk.yandex.ru/d/YoyGQoppUw5Cfg/8-9/.
Задание 5. Предложите эндонуклеазу(ы) рестрикции, с использованием которой(ых) можно было бы проверить эффективность встраивание целевого гена в векторную плазмиду. В качестве ответа укажите названия выбранных вами эндонуклеаз рестрикции, а также длины фрагментов ДНК, которые будут получены при гидролизе выбранными ферментами рекомбинантной плазмиды и векторной плазмиды.
Ответ: при гидролизе эндонуклеазами рестрикции SspI, BsaI векторной плазмиды будут получаться фрагменты длиной 3724 bp, 743 bp, а рекомбинатной плазмиды — 4471bp, 3529bp, 2740bp, 743bp; таким образом можно определить правильной полученной генетической конструкции.
Напишите эссе на тему «На какие “Большие вызовы”, которые стоят сегодня перед медицинской кибернетикой, могут ответить технологии управления свойствами биологических объектов?» Приведите конкретные примеры. Длина текста — до 2000 символов с пробелами
- сформулированы «Большие вызовы» (проблемы) медицинской кибернетики;
- определено, какие технологии управления свойствами биологических объектов могут помочь на них ответить;
- приведена аргументация, почему решение данных проблем имеет значение для медицинской кибернетики.
Оборудование и реагенты:
- Плазмида pQE30-GFP (концентрация 10 нг/мкл).
- 2Х Mastermix Pfu-Sso7d, 12,5 мкл (пробирка 0,2 мл).
- Праймеры For и Rev (прямой и обратный) для плазмиды pQE30-GFP, по 5 мкл, 2 мкМ (2 пробирки 0,6 мл).
- milliQ, деионизованная вода.
- Амплификатор.
- Автоматические дозаторы объемом 1–10 мкл.
- Наконечники для дозатора 10 мкл.
Протокол ПЦР:
- Приготовьте реакционную смесь для ПЦР в пробирке объемом 0,2 мл. Подпишите пробирку опознавательными знаками своей команды. Для этого добавьте следующие компоненты в пробирку с 12,5 мкл 2Х Mastermix Pfu-Sso7d (пробирка 200 мкл): по 2,5 мкл 2 мкМ прямого (пробирка F) и обратного праймеров и ___ мкл воды mQ. Суммарный объем реакционной смеси 25 мкл. (1 балл)
- В реакционную смесь внесите 1 мкл раствора плазмиды pQE30-GFP (пробирка ПЛ) и ресуспендируйте пипетированием в пробирке.
- Поместите полученную реакционную смесь для ПЦР в амплификатор.
| Число циклов | Этап | Температура, °C | Время, с |
|---|---|---|---|
| 1 | Денатурация | 98 | 30 |
| 25 | Денатурация | 98 | 10 |
| Отжиг праймеров | 68 | 20 | |
| Элонгация | 72 | 180 | |
| 1 | Элонгация | 72 | 120 |
Электрофорез в агарозном геле:
- Агароза; буфер 1\(\times\)TAE; бромистый этидий.
- Маркер электрофоретической подвижности Sky-High (Биолабмикс).
- 4\(\times\)краситель для нанесения ДНК (Биолабмикс).
- Камера для проведения электрофореза; трансиллюминатор или гель-док.
- Автоматические дозаторы объемом 1–10 мкл.
- Наконечники для дозатора 10 мкл.
Протокол агарозного электрофореза
- Для приготовления 1%-го геля прилейте к навеске агарозы массой 1 г 100 мл 1\(\times\)TAE, доведите до кипения и растворите всю навеску при перемешивании. После остывания раствора агарозы до 50 °C добавьте 5 мкл бромистого этидия (10 мг/мл), перемешайте и перелейте раствор в форму для заливки геля.
- В пробирку на 0,6 мкл внесите 6 мкл ПЦР продукта из ПЦР-пробирки. Внимание! Оставшийся ПЦР продукт (\(\sim\)19 мкл) передайте организаторам, он будет необходим для дальнейшей работы. К 6 мкл отобранного образца добавьте __ мкл 4Х буфера для нанесения и перемешайте пипетированием.
- Нанесите на агарозный гель 6 мкл подготовленного образца, смешанного с краской.
- Нанесите на агарозный гель 2 мкл маркера длин ДНК.
- Проведите электрофорез в следующих условиях: 120 В, 45 мин.
- Получите изображения геля после электрофореза.
Для классической ПЦР используют Taq-полимеразу, которая была выделена из термофильной бактерии Thermus aquaticus во второй половине XX века. С задачей ПЦР-диагностики (амплификации коротких фрагментов ДНК и их визуализации в агарозном геле или с детекцией в режиме реального времени) Taq-полимераза справляется отлично. Недостатком этой полимеразы является относительно низкая точность, так как у нее отсутствует \(3^\prime\)-\(5^\prime\) экзонуклеазная корректирующая (proofreading) активность. Taq-полимераза допускает около 1 ошибки (неправильно встроенного нуклеотида) на каждые 9000 нуклеотидов.
Для того чтобы клонировать ПЦР-продукты в следующий вектор, такой точности недостаточно, особенно в случае протяженных фрагментов ДНК (некоторые гены могут иметь длину значительно больше 9000 нуклеотидов).
Для амплификации протяженных фрагментов обычно используют ДНК-полимеразу Pfu, выделенную из археи Pyrococcus furiosus (оптимальная температура роста — 100 °C). Pfu содержит экзонуклеазный корректирующий домен и поэтому имеет точность около 1 ошибки на 1–1,3 млн нуклеотидов.
Для максимально точной амплификации используют «фьюжн» (слитую, химерную) ДНК-полимеразу Pfu-Sso7d, в которой к полимеразе Pfu добавлен ДНК-связывающий белок Sso7d термофильной археи Sulfolobus solfataricus, который связывает малую бороздку ДНК и стабилизирует комплекс полимеразы с матрицей.
Задание 1. Перечислите принципы репликации, которые имеют отношение к ПЦР.
Ответ: комплементарность, антипараллельность, униполярность.
Задание 2. Почему процессивности и точности Taq-полимеразы недостаточно для использования в клонировании? К чему может привести использование Taq-полимеразы для клонирования гена? (2 балла)
Ответ: если ДНК-полимераза совершит ошибку в первых циклах амплификации (чего нельзя исключить), то эта ошибка сохранится во всех следующих циклах ПЦР; использование неточной полимеразы может привести к изменению аминокислотной последовательности или появлению стоп-кодонов в кодирующей последовательности.
Задание 3. Предположите, как помогает увеличить точность «фьюжн»-полимеразы домен Sso7d? (1 балл)
Ответ: снижает вероятность диссоциации ДНК-полимеразы от матрицы, увеличивает процессивность, работает аналогично PCNA («скользящей застежки»).
Задание 4. Почему после клонирования даже высокоточной ДНК-полимеразой всегда секвенируют получившуюся конструкцию? (1 балл)
Ответ: потому что нельзя исключить возникновение ошибки, которые могут повлиять на последовательность нуклеотидов.
Задание 5. Какие компоненты, кроме ДНК-полимеразы, содержит мастер-микс? (1 балл)
Ответ: dNTP, буферные компоненты, \(\ce{MgCl2}\).
Изучите фрагмент матрицы ДНК, использованной для ПЦР (см. рис.8).
В ПЦР были использованы следующие праймеры:
For \(5^\prime\)-CACCCTGACCCATGGCGTGCAGT-\(3^\prime\),
Rev \(5^\prime\)-GTGACCAGGGTTGGCCATG-\(3^\prime\)
Задание 6. На фрагменте матрицы ДНК укажите места отжига праймеров. Какой из праймеров отвечает за появление мутации в итоговом ПЦР продукте? (2 балла)
Ответ: прямой.
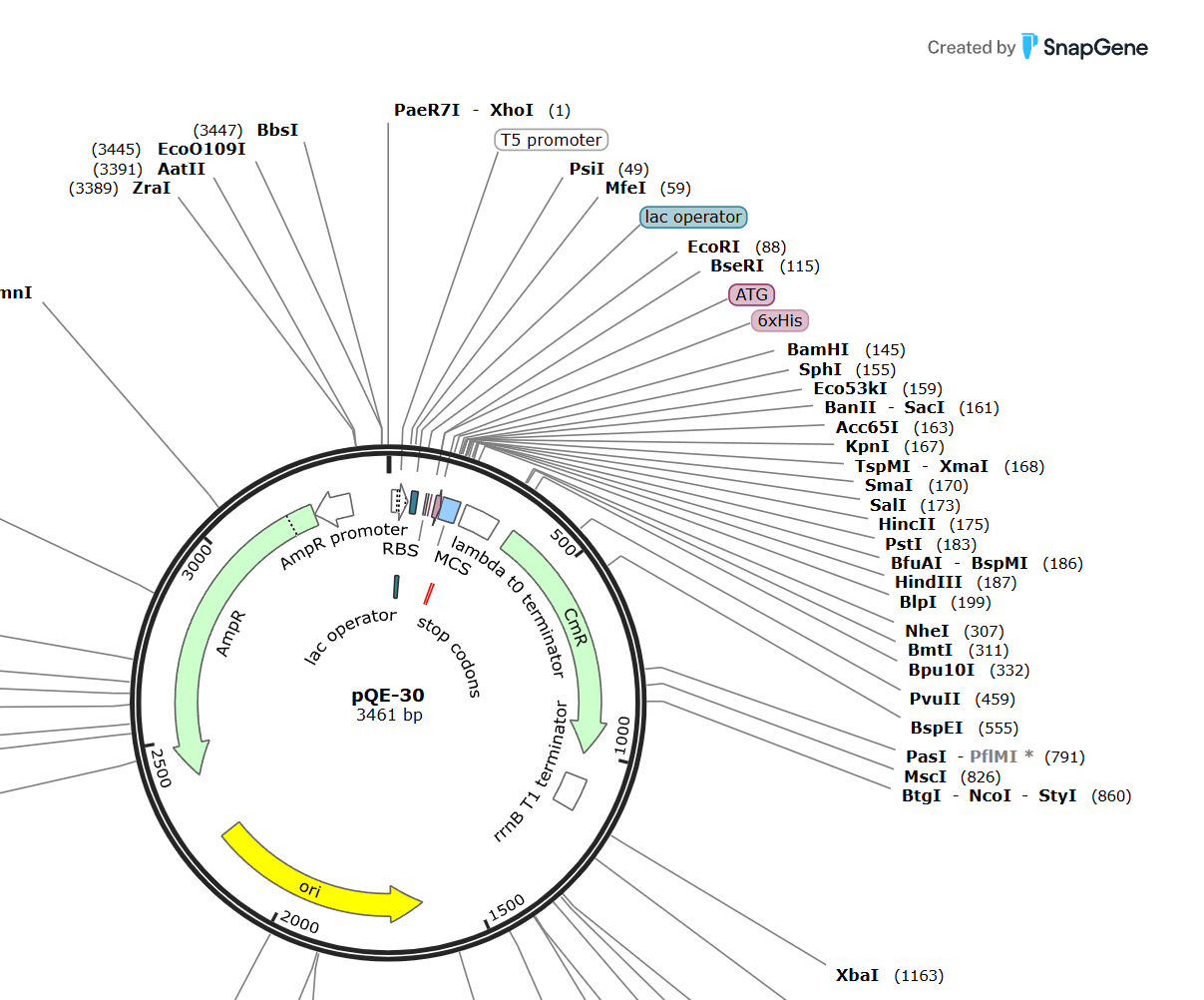
Задание 7. На схеме плазмиды pQE-30 (см. рис. 6.3) найдите участок, по которому был встроен ген GFP, укажите его обозначение _____. Предположите, какой продукт был получен в результате амплификации. Нарисуйте продукт на схеме. (1 балл)
Ответ: MCS (сайт множественного клонирования); вся плазмида.
На рис. 6.4 схематически изображены структуры плазмиды pQE-30, имеющие отношение к наработке рекомбинантных белков.
Задание 8. Запишите, с какого участка начинается и на каком участке заканчивается синтез мРНК (если предположить, что в нее уже встроен ген GFP)? (2 балла)
Ответ: +1 нуклеотид (MfeI, lac operator — справа); lambda t0 terminator.
Задание 9. Для чего нужна конструкция, обозначенная «6xHis», на каком конце белка она будет находиться? (1 балл)
Ответ: на N-конце; необходима для выделения и очистки белка аффинной хроматографией на хелатирующем сорбенте Ni-NTA или аналоги.
Задание 10. Для того чтобы стимулировать синтез GFP на плазмидах, подобных pQE-30, используют вещество ИПТГ, которое удаляет белок-репрессор и стимулирует транскрипцию гена (например, GFP). С каким участком связывается белок-репрессор? Запишите его название. (1 балл)
Ответ: lac-operator.
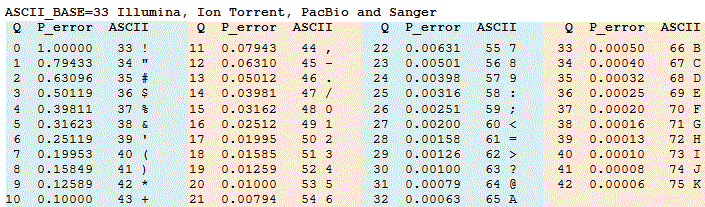
В биоинформатике качество прочтений из секвенатора играет важную роль для дальнейшего анализа. Однако часто прочтения содержат участки с низким качеством на 5\(^\prime\) и 3\(^\prime\) концах, которые необходимо удалить. Это процесс называется триммингом. Участникам предстоит реализовать программу, которая выполняет тримминг прочтений с использованием алгоритма плавающего окна.
Формат входных данных
На вход программе подается файл в формате FASTQ. Каждое прочтение в FASTQ-файле состоит из четырех строк:
- Идентификатор прочтения (начинается с символа @).
- Последовательность нуклеотидов (в направлении от 5\(^\prime\) до 3\(^\prime\) конца).
- Строка-разделитель (обычно начинается с +).
- Строка качества, закодированная в формате Phred+33 (каждый символ (ASCII) соответствует качеству нуклеотида (Q) из строки с последовательностью нуклеотида).
Алгоритм плавающего окна:
- Для каждого прочтения анализируется строка качества.
- Используется окно фиксированного размера (например, 5 нуклеотидов), которое «скользит» по строке качества.
- Если среднее качество в окне ниже заданного порога (например, 20), то прочтение обрезается до этого окна.
- Тримминг выполняется как с 5\(^\prime\) конца, так и с 3\(^\prime\) конца.
Задание. Напишите функцию, которая принимает на вход файл с прочтениями в формате fastq. Название выходного файла и параметры: window_size (размер окна, по умолчанию 5), quality_threshold (порог качества, по умолчанию 20) и min_length (минимальная длина прочтения после тримиинга, по умолчанию 5).
Функция должна выполнить тримминг последовательности с заданными параметрами и записать последовательности после тримминга в выходной файл. Если в результате тримминга длина прочтения меньше заданной, то такое прочтение не должно записываться во входной файл. Пример входного файла: Test_Input.fastq, пример выходного файла (для работы программы со значениями по умолчанию): Test_Output.fastq.
Добавьте в функцию сбор характеристик библиотек прочтений до и после фильтрации. Функция должна собирать следующие характеристики:
- количество прочтений до и после фильтрации,
- средняя длина прочтения до и после фильтрации,
- средний процент оснований с качеством выше Q30 до и после фильтрации,
- средний ГЦ-состав до и после фильтрации.
Данные характеристики должны быть записаны в отдельный файл.
- Реализован тримминг строки с качеством прочтения — 3 балла.
- Реализован тримминг последовательности прочтения — 2 балла.
- Реализован сбор характеристик до и после тримминга — 4 балла.
- Реализовано чтение из файла и запись результата в файл — 1 балл.
Ответ
def ordd(a):
return ord(a)-33
def chrr(a):
return chr(a+33)
def srsum(s,q):
qw=0
for i in s:
qw+=ord(i)-33
if q>qw/len(s):
return False
return True
def srlen(b):
s=[len(a[1]) for a in b]
return sum(s)/len(b)
def kach(b,qwerty):
s=''
o=0
for a in b:
s+=a[2+qwerty]
for i in s:
if ord(i)-33 > 30:
o+=1
return o*100/len(s)
def gc(b):
s=''
o=0
for a in b:
s+=a[1]
for i in s:
if i=='G' or i=='C':
o+=1
return o*100/len(s)
def trimming(b,win,q,minn):
ans=[]
for a in b:
an=[]
istrue=True
ii=0
while srsum(a[2][ii:ii+win],q)==False and ii<len(a[1])+1-win:
ii+=1
i=ii
qq=ii
while srsum(a[2][i:i+win],q) and i<len(a[1])+1-win:
qq=i+win
i+=1
if a[1][ii:qq]!='' and len(a[1][ii:qq])>=minn:
an.append(a[0])
an.append(a[1][ii:qq])
an.append("+")
an.append(a[2][ii:qq])
ans.append(an)
return ans
def function_main(myfile_input, myfile_output, window_size = 5, quality_threshold = 20, min_length = 5):
characteristic=[]
with open(myfile_input) as f:
a=[i.replace("\n","") for i in f]
asv=[[a[i],a[i+1],a[i+3]] for i in range(len(a)) if a[i][0] == '@']
characteristic.append("Количество прочтений до фильтрации: "+str(len(asv)))
characteristic.append("Средняя длина прочтения до фильтрации: "+str(srlen(asv)))
characteristic.append("Средний процент оснований с качеством выше Q=30 до фильтрации: "+str(kach(asv,0))+" %")
characteristic.append("Средний ГЦ-состав до фильтрации: "+str(gc(asv))+" %")
answer=trimming(asv, window_size,quality_threshold,min_length)
characteristic.append("Количество прочтений после фильтрации: "+str(len(answer)))
characteristic.append("Средняя длина прочтения после фильтрации: "+str(srlen(answer)))
characteristic.append("Средний процент оснований с качеством выше Q=30 после фильтрации: "+str(kach(answer,1))+" %")
characteristic.append("Средний ГЦ-состав после фильтрации: "+str(gc(answer))+" %")
with open(myfile_output, 'w+') as f:
for a in answer:
for i in a:
f.write(i+"\n")
with open('Characteristics.txt', 'w+') as f:
for i in characteristic:
f.write(i+"\n")
function_main('Test_Input.fastq', 'result')
Оборудование и реактивы:
- Продукт ПЦР, полученный в первый день, плазмида pQE30-mutGFP, если ПЦР прошла неудачно (пробирка 0,6 мл).
- Электрокомпетентные клетки E. coli штамма BL21, 50 мкл (1 пробирка, 0,6 мл).
- Среда SOC, 950 мкл (1 пробирка, 1,5 мл).
- 1 М ИПТГ (изопропил-бета-D-тиогалактозид);
- Супероптимальная среда c катаболической репрессией SOC 1 мл (Super Optimal broth with Catabolite repression): 2% триптон, 0,5% дрожжевой экстракт, 10 мМ \(\ce{NaCl}\), 2,5 мМ \(\ce{KCl}\), 10 мМ \(\ce{MgCl2}\), 10 мМ \(\ce{MgSO4}\), 20 мМ глюкоза.
- Чашки Петри с агаризованной средой LB и ампициллином.
- Одноразовые шпатели Дригальского.
- Термостат для пробирок.
- Центрифуга.
- Инкубатор с перемешиванием для пробирок.
- Инкубатор для чашек Петри.
- Автоматический дозатор объемом 1–10 мкл и 20–200 мкл.
- Наконечники для дозатора 10 мкл, 200 мкл, 1000 мкл.
Протокол электропорации:
- Пробирки со средой SOC разморозить в термостате при 37 °C.
- Разморозить бактериальные клетки на льду (5–10 мин).
- Плазмиды и кюветы для электропорации охладить на льду.
- Добавить 1 мкл плазмиды или ПЦР-продукта в пробирку с клетками.
- Перенести клеточную суспензию в кювету для электропорации и равномерно распределить.
- Поместить кювету в электропоратор.
- Запустить программу Ecl, нажать кнопку
pulseдля электрического импульса. - Быстро добавить к клеткам теплую среду SOC.
- Аккуратно ресуспендировать клетки в кювете, перенести в пробирку, подписать.
- Инкубировать электропорированные клетки в шейкер-инкубаторе при 37 °C в течение 30–60 мин.
Перенос бактерий на чашку Петри:
- Открутить клетки на настольной центрифуге при 6000 rpm в течение 3 мин.
- Занести пробирки с клетками под ламинар.
- Аккуратно слить супернатант, оставить на дне 20–50 мкл жидкости.
- Ресуспендировать клетки.
- Втереть в чашку Петри 40 мкл 1 М ИПТГ стерильным шпателем Дригальского.
- Перенести бактерии на чашку Петри, растереть (можно тем же самым) шпателем Дригальского до полного впитывания. Подписать чашку Петри со стороны среды.
- Инкубировать чашки Петри в инкубаторе при 37 °C в течение ночи.
На контрольную чашку организатор наносит бактерии, трансформированные по тому же протоколу плазмидой pQE30-GFP, с немутированным геном GFP.
Клетки кишечной палочки неохотно принимают ДНК из окружающей среды. Компетентность клеток обычных штаммов E. coli составляет \(10^{-5}-10^{-10}\). Обычно для трансформации клеток, которые «компетентны», то есть эффективно усваивают ДНК из окружающей среды, используют два подхода — тепловой шок и электропорацию. Оба этих процесса связаны с нанесением клеткам повреждений, который вызывают стресс. А именно стресс является фактором, при котором клетки начинают поглощать ДНК из внеклеточной среды (чтобы выжить).
Повышение температуры клеток (тепловой шок) и быстрое охлаждение во льду при химической трансформации приводит к повышению проницаемости мембраны для внеклеточной ДНК. Клетки предварительно обрабатывают \(\ce{CaCl2}\) или другими солями (в т. ч. кобальта и рубидия). Затем замораживают в жидком азоте и хранят при \(-70 °\)C.
Для электропорации клетки отмывают ледяной дистиллированной водой, чтобы отмыть соли, и осаждают в 10%-м глицерине. Затем замораживают в жидком азоте и хранят при \(-70 °\)C.
После приготовления (и заморозки) проверяют эффективность трансформации компетентных клеток.
\[\begin{gather} \text{Эффективность\ трансформации} \left( \frac{\text{КОЕ}}{\text{мкг}} \right) = \\ = \ \frac{\text{КОЕ}}{\text{\#\#}\ \text{мкг\ ДНК}} \times \frac{\text{\#\#}\ \text{мкл\ трансформантов,\ нанесенных\ на\ чашку}}{\text{\#\#}\ \text{мкл\ нанесенных\ клеток}} \times\\ \times \text{разбавление\ при\ переносе\ на\ чашку\ Петри}. \end{gather}\]
Задание 1. Предположим, что на чашке выросло 300 колоний. В пробирку было добавлено 6,25 нг ДНК, объем клеток, трансформацию которых проводили — 100 мкл, на чашку нанесли 20 мкл, разбавление в 5 раз. Вычислите эффективность трансформации. (2 балла)
Ответ: от 240000 до 1200000 КОЕ/мкг.
Задание 2. Какие физико-химические процессы происходят с ДНК и бактериальной клеткой при электропорации? (1 балл)
Ответ: в клеточной стенке и плазматической мембране бактерий под действием электрического импульса образуются поры, через которые в цитоплазму клеток попадает (также под действием тока) отрицательно заряженная ДНК.
Задание 3. Какое значение имеет перенос бактериальных клеток в SOC на 1 ч? Почему эффективность трансформации может быть значительно снижена, если клетки сразу же растереть на чашку Петри? (2 балла)
Ответ: в среде SOC — оптимальные условия для роста клеток, происходит наработка продуктов генов устойчивости к антибиотикам; клетка репарирует повреждения ДНК (например, возникающие при мутагенезе), и за 1 ч клетка делится 1–2 раза, выживают только клетки с относительно целым геномом; если клетки сразу же растереть на чашку Петри, то не успеет наработаться фермент, который обеспечивает устойчивость к антибиотику, и выживет значительно меньше клеток, а эффективность трансформации будет сильно снижена
Задание 3. Если предположить, что клетка E. coli делится каждые 30–40 мин, достаточно ли инкубировать их на среде SOC в течение этого времени? (1 балл)
Ответ: 1 ч достаточно, чтобы клетки поделились 2 раза, поврежденным электропорацией клеткам может требоваться больше времени, поэтому данный этап не рекомендуют сокращать до 30–40 мин.
Задание 4. Почему клетки, трансформированные плазмидами, несущими некоторые гены устойчивости к антибиотикам, после трансформации инкубируют более длительное время (до 2–3 ч) перед нанесением на чашку Петри с данным антибиотиком? (1 балл)
Ответ: некоторым генам устойчивости к антибиотикам требуется больше времени на экспрессию белка в достаточном количестве для обеспечения защиты клетки от антибиотика.
Задание 5. Для скрининга (выявления) клеток, которые содержат плазмиду со вставкой, часто используют бело-синюю селекцию. В таком случае в среду с агаром кроме антибиотика и ИПТГ добавляют бесцветное вещество X-gal, которое является субстратом для фермента бета-галактозидазы. Фермент превращает X-gal в синее соединение 4-хлоро-3-бромо-индиго. Известно, что колонии, содержащие вставку — белые, а несодержащие — синие.
Предположите, как устроена плазмида, какие гены она содержит и где относительно этих генов находится MCS-сайт множественного клонирования (содержит подряд несколько сайтов рестрикции). Нарисуйте плазмиду, обозначьте гены и MCS. (2 балла)
Ответ: нарисована кольцевая плазмида, которая содержит ori, ген устойчивости к антибиотику, MSC внутри гена lacZ, перед lacZ есть промотор и старт-кодон, в конце — терминатор и стоп-кодон.
Задание 6. Какие результаты бело-синей селекции следует ожидать от трансформации бактерий плазмидой без встройки? (1 балл)
Ответ: колонии будут синими, так как последовательность гена lacZ без встройки не будет нарушена.
Задание 7. Как при бело-синей селекции будут выглядеть на чашке Петри с антибиотиком клетки, в которые не попала плазмида? (1 балл)
Ответ: бактерии не вырастут, так как не содержат гена устойчивости к антибиотику, который содержится в плазмиде.
Задание 8. Какие результаты бело-синей селекции следует ожидать от трансформации бактерий, если в бактерию попала только вырезанная рестриктазами ДНК, но не плазмида? (1 балл)
Ответ: бактерии не вырастут, так как ген устойчивости к антибиотику находится в плазмиде.
Задание 9. Какие результаты бело-синей селекции следует ожидать от трансформации бактерий, если по MCS встроился «неправильный» фрагмент ДНК? (1 балл)
Ответ: колонии будут белыми, так как ген будет нарушен.
Задание 10. Как можно проверить корректность фрагмента, встроившегося в плазмиду? Предложите несколько вариантов. (2 балла)
Ответ: секвенирование, ПЦР, рестрикционный анализ.
Рецепторы, связанные с G-белком (GPCRs), представляют собой обширное семейство трансмембранных рецепторов, играющих ключевую роль в передаче сигналов внутри клеток. Они состоят из семи трансмембранных доменов, соединенных вне- и внутриклеточными петлями.
GPCRs активируются различными лигандами, включая гормоны, нейромедиаторы и свет. После активации рецептор взаимодействует с гетеротримерным G-белком, состоящим из \(\alpha\)-, \(\beta\)- и \(\gamma\)-субъединиц. Это взаимодействие приводит к диссоциации G-белка на активную \(\alpha\)-субъединицу и \(\beta\gamma\)-комплекс, которые могут модулировать активность различных эффекторных молекул, таких как аденилатциклаза, фосфолипаза C и ионные каналы. В результате происходит каскад биохимических реакций, приводящих к изменению клеточной активности.
Таким образом, GPCRs являются важными мишенями для разработки лекарственных препаратов, поскольку они участвуют во многих физиологических процессах и патогенетических механизмах заболеваний.
Задание 1. Используя базы данных NCBI, найдите последовательность аминокислот белка GPCR G protein coupled receptor (NP_175700.2 [GeneID=841725]). (3 балла)
Ответ
Искомая последовательность:
1 mgerffrnem pefvpedlsg eeetvteckd sltkllslpy ksfseklhry alsikdkvvw
61 etwersgkrv rdynlytgvl gtayllfksy qvtrneddlk lclenveacd vasrdservt
121 ficgyagvca lgavaakclg ddqlydryla rfrgirlpsd lpyellygra gylwaclfln
181 khigqesiss ermrsvveei fragrqlgnk gtcplmyewh gkrywgaahg lagimnvlmh
241 telepdeikd vkgtlsymiq nrfpsgnyls segsksdrlv hwchgapgva ltlvkaaqvy
301 ntkefveaam eagevvwsrg llkrvgichg isgntyvfls lyrltrnpky lyrakafasf
361 lldkseklis egqmhggdrp fslfegiggm aymlldmndp tqalfpgyel
Последовательность в одну строку: mgerffrnempefvpedlsgeeetvteckdsltkllslpyksfseklhryalsikdkvvwetwersgkrvrdynlytgvlgtayllfksyqvtrneddlklclenveacdvasrdservtficgyagvcalgavaakclgddqlydrylarfrgirlpsdlpyellygragylwaclflnkhigqesissermrsvveeifragrqlgnkgtcplmyewhgkrywgaahglagimnvlmhtelepdeikdvkgtlsymiqnrfpsgnylssegsksdrlvhwchgapgvaltlvkaaqvy
Задание 2. Используя инструмент для предсказания трехмерной структуры белков — AlphaFold2, проведите сворачивания белковой молекулы в трехмерную структуру. (https://colab.research.google.com/github/sokrypton/ColabFold/blob/main/AlphaFold2.ipynb) С каким из приведенных ниже белков у GPCR G совпадает трехмерная структура? (3 балла)
- GNA14 G protein subunit alpha 14 [NP_004288.1 GNA14 [GeneID=9630]]
- GNL3 G protein nucleolar 3 [NP_055181.3 GNL3 [GeneID=26354] [isoform=1]]
- Rho rhodopsin [XP_006505923.1 Rho [GeneID=212541] [isoform=X1]]
- OPN1SW opsin 1, short wave sensitive [NP_001372054.1 OPN1SW [GeneID=611]]
Ответ
На сайте AlphaFold Server (https://alphafoldserver.com/) была проведена вставка вышеприведенной аминокислотной последовательности и обозначена в окошке Entity tipe как Protein. В copies было сохранено число 1.
После нажатия кнопки Continue and Preview через некоторое время была представлена трехмерная структура GPCR G:
По схожему алгоритму были найдены структуры других белков:
- Структура GNA 14 G protein subunit alpha.
- Структура GNL3 G protein nucleolar 3.
- Структура Rho rhodopsin.
- Структура OPN1SW.
Таким образом, у GPCR G может совпадать структура с Rho rhodopsin.
Задание 3. PLDDT (Predicted Local Distance Difference Test) — это метод оценки качества предсказанных трехмерных структур белков. PLDDT является частью алгоритма AlphaFold2, который используется для моделирования белковых структур. Данный показатель представляет собой оценку достоверности предсказания расстояния между атомами углерода. Значение PLDDT варьируется от 0 до 100, где:
- высокие значения (близкие к 100) указывают на высокую уверенность в точности предсказанной структуры;
- низкие значения (близкие к 0) свидетельствуют о низкой уверенности и возможной ошибке в модели.
Какая часть в полученной структуре имеет наибольший PLDDT и почему? (3 балла)
Ответ
Наибольший plDDT в структуре GPCR G protein coupled receptor имеют глобулярные домены в центре белка. Это связано с тем, что глобулярные домены эволюционно более консервативны, и поэтому у программы AlphaFold2 для этих частей молекулы есть больше информации для предсказания структуры PLDDT ближе к значению 100 в основной части глобулы, в скоплении альфа-спиралей в структуре белка.
Задание 4. Проведите выравнивание последовательности аминокислот GPCR G и белка, трехмерная структура, которого схожа с GPCR G. (Для этого можете воспользоваться любым доступным инструментом, например: https://www.ebi.ac.uk/jdispatcher/msa/muscle) Сколько аминокислот совпали? (3 балла)
Ответ
На сайте https://en.vectorbuilder.com/tool/sequence-alignment.html проведено выравнивание последовательностей GPCR G и Rho rhodopsin. Таким образом, полных совпадений аминокислот 118, similarity 195.
Задание 5. Исходя из знаний об эволюции, белках и функциях белковых структур, с которыми вы работали, объясните, чем обусловлены такие результаты? (3 балла)
Ответ
Уровень гомологии аминокислотных последовательностей в исследуемых белках составляет 20–30%, что указывает на ограниченное сходство на первичном структурном уровне. Филогенетический анализ позволяет предположить, что эти белки, вероятно, имеют общее эволюционное происхождение, однако их биохимические пути дивергировали, что привело к различиям в первичной структуре. Тем не менее, функциональная и структурная близость дает основания рассматривать их как потенциальных представителей единой надсемейной группы белков.
Интересно, что трехмерная структура белков демонстрирует большее сходство, чем их аминокислотные последовательности. Это может объясняться двумя гипотезами:
- Конвергентная эволюция: белки независимо приобрели схожую пространственную организацию из-за выполнения аналогичных функций (в данном случае — участие в передаче клеточных сигналов).
- Эволюционная преемственность: один из белков мог стать структурным прототипом для другого, сохранив ключевые элементы третичной структуры, необходимые для функциональности.
При этом низкая степень гомологии последовательностей исключает возможность их недавнего дублирования, что подчеркивает сложность эволюционных взаимоотношений между белками, а также тот факт, что третичная структура белка более консервативна, чем последовательность аминокислот.
Оборудование и реактивы:
- Комплект плазмид для идентификации (пробирки 0,6 мл с цифровыми обозначениями ___ и ___) по 11 мкл плазмиды с концентрацией 40 нг/мкл.
- Рестрикционные буферы: 10хSE-буфер B, 10хSE-буфер G, 10хSE-буфер O, 10хSE-буфер W, 10хSE-буфер Y, 10хSE-буфер ROSE (Сибэнзайм).
- Эндонуклеазы рестрикции: Acc16 I, 5 ед./мкл, BamH I, 5 ед./мкл, Pst I, 5 ед./мкл, Vne I, 5 ед./мкл (Сибэнзайм).
- Деионизованная вода класса milliQ (1 мл).
- Автоматические дозаторы объемом 1–10 мкл, 20–200 мкл.
- Наконечники для автоматического дозатора: 10 мкл, 200 мкл.
- Термостат.
Задание
В ходе работы нужно с помощью рестрикицонного анализа определить, какие две плазмиды выданы. Карты плазмид представлены на рис. 6.7: обозначены название, размер плазмиды, а также расположение сайтов, по которым гидролизуют эндонуклеазы рестрикции Acc16 I, BamH I, Pst I и Vne I.
Для анализа следует использовать пару эндонуклеаз рестрикции, то есть одновременно в одной пробирке провести гидролиз ДНК плазмиды двумя ферментами (Acc16I + BamH I) или (Pst I + Vne I). В результате у каждой команды получится по четыре пробирки с реакционными смесями.
Для того чтобы рестриктазы работали корректно, необходимо подобрать оптимальный реакционный буфер. При использовании неоптимального буфера возможно появление звездчатой активности — снижения или изменения специфичности эндонуклеаз рестрикции (https://ru.wikipedia.org/wiki/Эндонуклеазы_рестрикции). В результате фермент будет неизбирательно разрезать ДНК, и полученные в ходе такого эксперимента данные не позволят правильно идентифицировать плазмиду.
Ниже представлена таблица 1.4, отображающая активность эндонулкеаз рестрикции в разных буферных растворах. Необходимо подобрать для каждой пары рестриктаз оптимальный буферный растворы и провести рестрикционный анализ плазмид согласно протоколу.
| Фермент | Сайт узнавания | Активность в буфере, % от максимальной | Оптимальная температура, °C | |||||
| B | G | O | W | Y | R | |||
| Acc16 I | TGC\(\uparrow\)GCA ACG\(\downarrow\)CGT |
50–75 | 75– 100 | 25–50 | 100 | 75–100 | 70 | 37 |
| BamH I | G\(\uparrow\)GATCC CCTAG\(\downarrow\)G |
25–50 | 100 | 75–100 | 75–100 | 25–50 | 100 | 37 |
| Pst I | CTGCA\(\uparrow\)G G\(\downarrow\)ACGTC |
10– 25 | 25– 50 |
1100 | 25– 50 | 25– 50 | 50 | 37 |
| VneI | G\(\uparrow\)TGCAC CACGT\(\downarrow\)G |
10–25 | 25-50 | 100 | 25–50 | 25–50 | 100 | 37 |
Протокол:
- Возьмите две чистые пробирки объемом 0,6 мл и подпишите их так же, как обозначены две неизвестные выданные плазмиды.
- На обеих пробирках поставьте обозначение «A+B» («A» обозначает эндонуклеазу рестрикции Acc16 I, «B» — эндонуклеазу рестрикции BamH I).
- Возьмите еще две чистые пробирки объемом 0,6 мл и снова подпишите их так же, как обозначены две неизвестные выданные плазмиды.
- На обеих пробирках поставьте обозначение «P+V» («P» обозначает эндонуклеазу рестрикции Pst I, «V» — эндонуклеазу рестрикции Vne I).
- Внесите в каждую из пробирок соответствующие реагенты в количестве, указанном в таблице. Порядок добавления реагентов следующий: вода mQ, 10Х буфер, плазмиды, рестриктазы (по 2 шт!). Конечный объем реакционной смеси — 10 мкл.
- Поместите реакционные смеси в твердотельный термостат на 37 °C на 30 мин.
| Компонент | Плазмида «__» «A+B» | Плазмида «__» «A+B» | Плазмида «__» «P+V» | Плазмида «__» «P+V» |
|---|---|---|---|---|
| milliQ | мкл | мкл | мкл | мкл |
| 10Х буфер | мкл | мкл | мкл | мкл |
| Название буфера | ||||
| Плазмида «__» | 4 мкл | — | 4 мкл | — |
| Плазмида «__» | — | 4 мкл | — | 4 мкл |
| Acc16 I | 1 мкл | 1 мкл | — | — |
| BamH I | 1 мкл | 1 мкл | — | — |
| Pst I | — | — | 1 мкл | 1 мкл |
| Vne I | — | — | 1 мкл | 1 мкл |
Оборудование и реактивы:
- Агароза, буфер 1\(\times\)TAE, маркер длин ДНК.
- Камера для горизонтального электрофореза.
- Трансиллюминатор.
- Автоматические дозаторы объемом 1–10 мкл.
- Наконечники для дозатора 10 мкл.
Протокол:
- Для приготовления геля прилейте к навеске агарозы массой 1 г 100 мл 1\(\times\)TAE, доведите до кипения и растворите всю навеску при перемешивании. После остывания раствора агарозы, установите в форму гребенки и перелейте раствор агарозы.
- Добавьте к образцам по __ мкл 6Х красителя для нанесения на гель.
- Нанесите на гель весь объем каждой из реакционных смесей с буфером для нанесения, запишите порядок нанесения образцов.
- Нанесите на агарозный гель маркер длин ДНК.
- Запустите электрофорез в следующих условиях: 120 В, 40 мин.
- Получите изображения геля после электрофореза с помощью трансиллюминатора.
- Проведите анализ продуктов рестрикции, установите, какие плазмиды были выданы команде.
Задание 1. Определите названия выданных вам плазмид: ___ — ______; ___ — ______. (2 балла)
Задание 2. Используя карты плазмид pVAX-RBD, pBR322, pBluescript и pCD63, вычислите размеры продуктов, которые должны получиться в результате гидролиза этих плазмид эндонуклеазами рестрикции. (1 балл)
| Плазмиды | Эндонуклеазы рестрикции | Длина продуктов, п. н. |
|---|---|---|
| pVAX-RBD | Acc16 I + BamH I | |
| Pst I + Vne I | ||
| pBR322 | Acc16 I + BamH I | |
| Pst I + Vne I | ||
| pBluescript | Acc16 I + BamH I | |
| Pst I + Vne I | ||
| pCD63 | Acc16 I + BamH I | |
| Pst I + Vne I |
Задание 3. Почему при проведении электрфоретического анализа в агарозном геле с последующим окрашиванием бромистым этидием не всегда удается увидеть короткие (менее 100 п. н.) продукты рестрикции? Всегда ли эти фрагменты будут видны при окрашивании SYBR и/или аналогичными интеркалирующими красителями? Предложите несколько объяснений. (2 балла)
Ответ: если плазмидная ДНК длиной 3000 п. н. видна при нанесении на гель 200 нг (как описано в данном протоколе), то фрагмент длиной 100 п. н. будет иметь массу в 30 раз меньше, около 7 нг. В данном случае он не будет визуализирован. Чтобы увидеть короткие продукты рестрикции, требуется взять исходно значительно больше плазмидной ДНК. При окрашивании SYBR продукт массой 7 нг будет заметен.
Первое приключение. Будущий молекулярный биолог Таисия решила клонировать фрагмент ДНК, полученный путем расщепления Kpn I, в вектор с концами, полученными расщеплением BamH I. Проблема в том, что концы BamH I и Kpn I несовместимы: BamH I оставляет липкий конец на \(5^\prime\)-конце, а Kpn I — на \(3^\prime\)-конце.
Опытный генетик Владимир посоветовал Таисии связать их олигонуклеотидной «шиной» так, как показано на схеме (см. рис. 6.9). Таисия сомневается, сработает ли такая схема, потому что для лигирования ДНК-лигазе нужны фосфат и гидроксильная группа.
Хотя молекулы, получаемые после рестрикции, имеют соответствующие концы, однако, олигонуклеотиды, получаемые химическим синтезом, обычно имеют гидроксильные группы на обоих концах. Кроме того, соединить нужно как фрагменты, полученные BamH I – Kpn I, так и Kpn I – BamH I. Таисия скептически относится к тому, что один и тот же олигонуклеотид может выступать в роли «шины» для двух этих соединений.
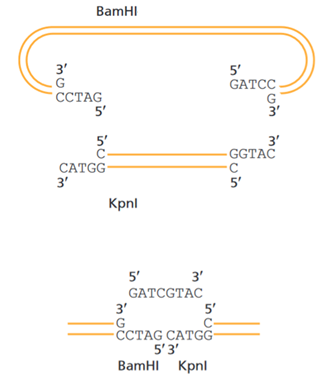
Задание 4. Подходит ли олигонуклеотид, приведенный на схеме, для этого эксперимента? Приведите аргументы. (1 балл)
Ответ: да, подходит.
Задание 5. Как нужно модифицировать олигонуклеотид, чтобы лигирование прошло успешно? Как называется этот фермент (или как бы вы его назвали)? Какой из концов олигонуклеотида должен модифицировать данный фермент? Нарисуйте схематически структуру олигонуклеотида, который будет эффективно лигирован. (2 балла)
Ответ: нужно добавить фосфат на \(5^\prime\)-конец. Фермент называется киназа (мог бы называться фосфатаза).
Второе приключение. Молекулярный биолог Марина исследует влияние гена T на одно метаболическое заболевание. В опытную группу собраны больные, а во контрольную группу — здоровые люди. Молекулярный генетик Владимир предполагает, что среди больных повышена частота редкого аномального аллеля t. Чтобы проверить эту гипотезу, Марина обрабатывает ПЦР-продукты, полученные с исследуемых образцов ДНК обеих групп, рестриктазой SolVI: у группы 1 (дорожки 1–10) и группы 2 (11–20).
Для определения длины продуктов Марина использует гель-электрофорез, результат которого приведен на рис. 6.10, цифрами справа обозначены длины фрагментов ДНК в п. н. Исходная длина фрагмента составляет 745 п. н.
Задание 6. Постройте рестрикционную карту для аллелей T и t, основываясь на том, что аллель t содержит сайт рестрикции. (2 балла)
Ответ: первый сайт рестрикции находится на 245 пн от края исходного фрагмента 745 пн. Второй сайт рестрикции находится внутри фрагмента длиной 500 пн и делит его на 295 и 205 пн.
Задание 7. Почему в ряде случае после рестрикции получается 2, 3, 4 полосы? Определите генотипы. (1 балл)
Ответ: 2 полосы — 1 сайт рестрикции, есть у всех пациентов, гомозигота по доминантому аллелю; 3 полосы — два сайта рестрикции, гомозиготы по рецессивному аллелю (полоса 500 превращается в 295 и 205), 4 полосы — гетерозиготы.
Задание 8. В какой группе находятся здоровые, а в какой — больные пациенты? (1 балл)
Ответ: гомозиготы по рецессивному аллелю (пациенты 13, 14) находятся во второй группе.
Задание 9. Является ли ген Т (и аллель t) удачным диагностически маркером? Почему? (1 балл)
Ответ: нет, так как он встречается не только у больных, но и у здоровых пациентов.
Задание 10. Можно ли считать, что гипотеза Владимира верна? Приведите аргументы. (1 балл)
Ответ: гипотеза верна, частота аллеля повышена. Однако нельзя назвать его удачным маркером.
Размер зерна — важный признак для урожайности пшеницы. Увеличение размера и массы зерна напрямую влияет на продуктивность растения. Одним из генов, регулирующих этот признак, является GW2 (Grain Width 2). В работах на рисе и пшенице было показано, что нокаут гена GW2 приводит к увеличению размера зерна и, как следствие, к повышению урожайности.
Мягкая пшеница (Triticum aestivum L.) — одно из самых важных сельскохозяйственных растений. Она имеет сложный аллогексаплоидный геном, возникший из трех близкородственных геномов в результате межвидовой гибридизации. Для пшеницы было показано наличие трех гомеологичных копий гена GW2, по одной в каждом из субгеномов (A, B и D). При этом нокаут только одной из копий может не привести к значительному увеличению размера зерна, поэтому необходимо нокаутировать все три копии.
Для нокаута генов пшеницы используется вектор pSH121. Он содержит ген, кодирующий эндонуклеазу SpCas9, каркас нРНК и маркерный ген устойчивости к антибиотику канамицину. В этот вектор по сайтам рестриктазы BasI клонируют разработанную нРНК в виде двуцепочечного олигонуклеотида с липкими концами (5\(^\prime\)-TGGC-3\(^\prime\) на 5\(^\prime\)-конце прямой цепи и 5\(^\prime\)-AAAC-3\(^\prime\) на 5\(^\prime\)-конце обратной цепи). Далее производится трансформация этим вектором растений и получение целевых мутантов.
Задача — разработать систему для нокаута всех трех гомеологичных копий гена GW2 пшеницы для увеличения размера зерна.
Задание 1. Используя ген GW2 из субгенома А (TraesCS6A02G189300), найдите гомеологов в субгеномах B и D. Опишите структуру найденных генов. Найдите участок для внесения мутации, совпадающий у всех трех гомеологичных копий. (4 балла)
Ответ: гомеолог в субгеноме B — TraesCS6B02G215300, гомеолог в субгеноме D — TraesCS6D02G176900; эти гены имеют по одному транскрипту, состоящему из 8 экзонов; длина транскрипта 1692–1733 пар оснований. Участок для внесения мутации должен находиться в начале гена и совпадать у всех трех гомеологов; оптимальный участок — совпадающий у всех трех гомеологов фрагмент первого экзона.
Задание 2. Используя рекомендуемые или любые другие инструменты, подберите нРНК для нокаута всех трех гомеологичных генов. Произведите оценку качества нРНК. Опишите расположение сайта рестрикции в гене, ГЦ-состав, предсказанную эффективность, наличие офф-таргетов для нРНК. (4 балла)
Ответ: пример оптимальной нРНК — \(5^\prime\)-GCTACGCAAGTTGATCCTCG-\(3^\prime\); эта нРНК попадает в первый экзон гена, ее ГЦ-состав — 55%, она имеет высокую предсказанную эффективность (overall score = 0,8), и отсутствуют офф-таргеты в других генах.
Задание 3. Выполните клонирование подобранной нРНК в вектор pSH121. (4 балла)
Ответ: пример плазмиды со вставкой в файле https://disk.360.yandex.ru/d/POUj9zZIa7UWKA.
Задание 4. После клонирования нРНК в вектор pSH121 необходимо проверить наличие вставки при помощи рестрикции. Выберите рестриктазы, которые позволят отличить вектор со вставкой от вектора без вставки на электрофорезе. Какой результат вы ожидаете увидеть в случае, если вставка произошла успешно? (4 балла)
Ответ: для проверки наличия вставки в плазмиде можно использовать рестриктазу BsaI; если в плазмиде нет вставки, то будет два фрагмента длиной 1222 и 10977 пар оснований, если вставка прошла успешно, то будет один фрагмент (не разрезанная плазмида) длиной 10996.
Задание 5. После трансформации растения вам предстоит проверить наличие мутации в генах GW2. Разработайте праймеры для секвенирования участка гена, в который будет внесена мутация. Какой результат секвенирования вы ожидаете увидеть в случае успешного нокаута? (4 балла)
Ответ: прямой праймер 5\(^\prime\)-AGCACAGGGATATCGACCAGA-3\(^\prime\), обратный праймер 5\(^\prime\)-GAAGCAGATGGGGCACTCCTC-3\(^\prime\); в случае успешного нокаута ожидается увидеть инсерцию или делецию количества нуклеотидов, не равного трем.
Рекомендуемые инструменты:
- Для работы с последовательностями — https://plants.ensembl.org/Triticum_aestivum/Info/Index, https://plants.ensembl.org/Multi/Tools/Blast.
- Для разработки нРНК — http://www.rgenome.net/cas-designer/, https://crispr.bioinfo.nrc.ca/WheatCrispr/.
- Для поиска оффтаргетов в геноме (версии IWGSC RefSeq v.1.0) — https://urgi.versailles.inra.fr/blast/.
- Для работы с вектором — http://ugene.net/ru/.
- Для подбора праймеров — https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHome.
- Для оценки качества праймеров — https://mcb.berkeley.edu/labs/krantz/tools/oligocalc.html.
Напишите эссе на тему «На какие “Большие вызовы”, которые стоят сегодня перед медицинской кибернетикой, могут ответить технологии управления свойствами биологических объектов?» Приведите конкретные примеры, длина текста до 2000 символов с пробелами.
- сформулированы «Большие вызовы» (проблемы) медицинской кибернетики;
- определено, какие технологии управления свойствами биологических объектов могут помочь на них ответить;
- приведена аргументация, почему решение данных проблем имеет значение для медицинской кибернетики.
- Канал «Практическая биоинформатика и молекулярная биология» цифровой кафедры НГУ.
- Группа в ВК https://vk.com/nsu_synbio.
- Образовательная программа для подготовки к профилю «Геномное редактирование» доступна в группе ВК https://vk.com/docs-173786512.
- Образовательная программа «Генетическая инженерия в школе» группа в ВК https://vk.com/genengschool.
- Канал в Ютубе https://www.youtube.com/@gen_eng.